�ԐM�@�������̂Ƃ���Ŏg�������Ƃ͂Ȃ��̂ŏڍׂ͂킩��܂��ANo.1�͍זE�f�ɁANo. 2,3,5�͑g�D�p�Ɏg���Ă���悤�ł��B����M����4�{�݂Ŏg�p����Ă��܂����B�������������A�ۂ������Ⴂ�͐F�����Ȃǂ��܂߂Ă��܂薳�������悤�Ɏv���܂��B�����j���̐��F���������ǂ��Ȃ��̂��A�ꂪ�������������܂����B���t���L�V���g�p��2�{�݂ł����B���ƃG���X���V���g�p��1�{�݂ł��B�m���ɐԖ��͋��������ł��ˁB����������͗��{�݂Ƃ��G�I�W�����ߐ��C���Ŋj�ɋ������Ă���̂�B����ł����B�����̏�ł̓L�T���e���n�F�f�̓G�I�W���Ɗ��\��͂قړ��������ǁA���q�ʂ��قȂ�̂ŗ������킹��Ƒ��ʂȐ��F��������Ƃ������Ƃł����A�ߐ����Ă��܂��Ă͉��̈Ӗ����Ȃ��Ȃ��Ȃ�܂��ˁB����̐��x�Ǘ��̏�����ɁA���̎{�݂ŃG�I�W���������̓w�}�g�L�V�����ɂ�鋤���������܂����B�w�}�g�L�V������G�I�W���ɉ����g���������A�Ƃɂ������ʂ���������s�����Ƃ̕����d�v�ł���ƌ�����Ǝv���܂��B
�ԐM�@Gill�̃w�}�g�L�V�������g�p���Ă����Ȃ��Ƃ������Ƃł��ˁB��{�I�Ƀw�}�`���ƃA���~�j�E���̕���������̂̐��F�t�ł�����ˁB�|�_�Ȃg���Ă���̂ŁA�G�I�W���̃m���Ȃ͋t�ɗǂ���������܂���ˁB�����������킯�ł͂Ȃ��̂ŗ\�z�̂��Ƃɔ������܂��ƁA�t���L�V���ɂ��Ă̓G�I�W����Cl���������t���������ł������Ǝv���܂��B�܂��A�t���L�V���ɂ��Ă̓G�I�W����Br�̕��������E�f�ɕς������̂��ƔF�����Ă��܂��B�������A�ǂ�������q�ʂ��G�I�W�����傫���ł��ˁB�P�ɉ��f���t�����ꂽ��A���E�f�ɒu������Ă����肵�Ă��邾���̂悤�ł����A����ɂ���Ē`�����ւ̋z���͈͂���Ă���Ǝv���܂��B�����̐F�f�́A�Ⴆ�Α����P�����ۂɂ悭�z�����铙�̓����͂Ȃ��̂ł��傤���B�܂��A���ۂɎg�p���Ă���{�݂łȂ��Ɖ�����Â炢��������܂���ˁB��{�I�Ƀw�}�g�L�V�����̐F���͐`���F�ŁA����ɃG�I�W���̐Ԃ�����Ď��F�ɂ݂���Ƃ������F�ł�����A���Ƃ��Ƌ������Ă���ƍl���Ă��ǂ��킯�ł��ˁB�v����Ƀo�����X�̖��Ȃ̂ł��傤�ˁB�G�I�W���́A�ԃC���N�̌����Ƃ��ĊJ������āA�G�I�W�����o�ꂷ��O�܂ł́A�痿�n�̐ԃC���N����̂ł����B�J���҂̎������Ж��͖Y��܂������A�e���|�����������ǂ����E�E�E�肩�ł���܂���B�����Ƃ��Ă͗L�@�ޗ��ŐԐF��悷����̂͑��݂��Ȃ������̂ŁAHE���F�ɃG�I�W�����g�����Ƃ������Ƃ͔��ɍŐ�[�̐F�f���g�p�����\���������Ǝv���܂��B�v���������A�������w���̂���ɁA�e�X�g�̍̓_�Ɏg�p����ԃy������ԐF�u�����Ă������Ƃ��v���o���܂����B���Ȃ݂ɁA���ʂɊւ��ẮA��͂艖�_�܂��͉��_�A���R�[�����g�p���Ă���{�݂������Ǝv���܂����A���̕������g�p���Ă���{�݂͂Ȃ������̂ł��傤���B
�ԐM�@��MERCK�̃J�^���O���Ɓ@Gill
No2,No3 �Ƃ��g�D.�זE�f���p�ƂȂ��Ă��܂��BNo3�̕��̃R�����g�ɂ́h�p����܂肪�ł��Z���A�v�����F���\�h�Ə����Ă���܂��B�����Papanicolau�p�Ƃ��ăn���X�̃w�}�g�L�V����������܂����A���ꂪ����t���[�ƂȂ��Ă��܂��B�Ȃɂ�������ǂ��̏d����������ɓ����Ă���̂ł��傤���ˁBWako�ł�No1�͍זE�f�����p�ANo2�͕a�������i�p���t�B���j�pNo3�͏p���g�D�����i�N���I�X�^�b�g�j�p�Ƃ��ėp�r�������Ă���܂��ˁB������ƋC����ς���Gill�������Ă݂Ă��ǂ������B�����̕s��ۂ�HE�̒������̋L�ڂŕ��ʂ̍�����������̂�Y��Ă��܂����̂Ŗ��L�ڂ�������A�t�������ď����Ă�������Ő������f�[�^�[���W�߂��Ă��Ȃ����ߏڍׂ͕s���ł��B���N�ȍ~�̉ۑ�ɂ��ĉ������B
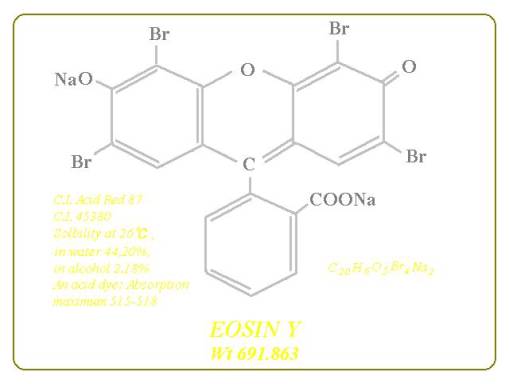
�ԐM�@�G�I�W���ɂ��āB�G�I�W���͕��ޏ�Xanthene�nbromofluoresceins�O���[�v�ɑ���EOSIN,
ETHYL EOSIN, EOSIN B.MBX(FAIT),Phloxine or Phloxine B�Ȃǂ��܂܂�Ă��܂��BERYTHROSIN B��Indofluoresceins�ɕ��ނ���Ă��܂��B�ڍׂ�EOSIN:
C20H6O5Br4Na2, C.I. Acid Red 87, mol. wt. 691.863, ETHYL EOSIN: C22H11O5Br4Na,
C.I. Solvent Red 45, mol. wt. 697.963, EOSIN B.MBX(FAIT); C20H6N2O9Br2Na2, C.I.
Acid Red 91, mol. wt. 624.066, Phloxine; C20H4O5Br4Cl2Na2, C. I. Acid Red 98,
mol. wt. 760.753, Phloxine B; C20H2O5Br4Cl4Na2, C. I. Acid Red 92, mol. wt.
829.644, ERYTHROSIN (Y); C20H8O5I2Na2, C.I. Acid red 95, mol. wt. 628.072,
ERYTHROSIN B; C20H6O5I4Na2, C.I. Acid Red 51, mol. wt. 879.865, Absorption
maximam (nm): EISON: 515-518, ETHYL EOSIN: 524-527, EOSIN B.MBX(FAIT); 516-519,
Phloxine; about 535.7,497.1, Phloxine B; 546-548�@ERYTHROSIN (Y); 510.5,
ERYTHROSIN B; 524-527, �ł��B(H.J. Conn's BIOLOGICAL STAINS�Q��) �ʔ��������̂��A�̂̐ԃ`���Ɏg���Ă����}�[�L�����N����(���ۂɂ��ꂩ�ǂ����͖Y��܂���)���A�G�I�W���̍\���ɔ��ɂ悭���Ă���_�ł��B�G�I�W����Br,Hg�����������Ŋ�{�\���͕ς�܂���B�E�ۍ�p��Hg�ɂ���Đ�����̂���?�֑��ł����A�Ƃ肠�����E�E�E�B
�ԐM�@�Ԏ����x��Ă��݂܂���B���{�݂̃G�I�W���̒����@�͎��̒ʂ�ł��B�P�jEosin Y5g�@������1000ml���_10mlEosin���������Ɋ��S�ɗn�����Ă��牖�_��������B��L���������A�����u����B�Q�j��L�̉t����߂��A���̂뎆�Ɏc���Ă��钾�a�����������ɂĖ�R���قǐ��B�i�����[���ɂȂ�ƘR�l�ɂӂ������Ă�������������J�n����j�R�j�R���ڂɐ�������A�뎆��̒��a��������ɂ���B�i���������ۑ������邱�Ƃ��\�j�S�j��L�̂뎆���ƒ��a����1000ml�̖����A���R�[������ꂽ�t���X�R�ɓ���悭�n�����B�T�j��L�̉t���g�p���ɂS�{�ɂ����߁A��߂��Ďg�p����B�ȏオ�쐻�ق��ł��B���܂�������悭�Ȃ��Ă��݂܂���B�܂��A���ۂɂ킩��Ȃ������炫���Ă��������B���Ȃ݂ɐ��F���Ԃ͂R���ł��イ�Ԃ�ɐ��܂��Ă��܂��B�Ԍ������P�����ۂ����Ȃ�n�f�ȃs���N�F�ɂȂ�̂ŁA�͂��߂͂�����������܂���B
�ԐM�@�d�����@���₵���ł��ˁB�����������������Ă���̂ł��傤���B����ɋ߂��������Ă����ƁE�E�E�B���������肩�ȁE�E�E�B�ł������͗����ɐe�a���������������Ȃ��E�E�E�B��قǒ��ׂĂ݂܂��B���w�厫�T�Ȃł���ׂĂ݂�ƁA����͐��̓��ł�SH��ȂƐe�a�������������ł��B���̓���SH��������̂Ƃ����ƃA�~�m�_�ł̓V�X�e�C�������Ȃ������Ǝv���܂��B�זE�����\�����鋅��`�����Ɋ܂܂��V�X�e�C���ɑ��Ĕ������Ċj�������܂�̂ł��ˁB�n���X�̃w�}�g�L�V������HE�W�{�Ŏ��ۂɂ͌������ƂȂ��̂łȂ�Ƃ������܂��A�זE�W�{�ł́A�Ȃ�ƂȂ��F�f���q���ׂ����Ă��炩���Ƃ��������̂悤�ȃN���}�`���̐��F���������ƋL�����Ă��܂��B����ƃw�}�`���̌����͋��炭�z�ʌ�������ł͂Ȃ����Ǝv����̂ł����A��Ȃǂ̂悤�Ȓ����^�̌������Ƃ���ƁA�z�ʎq�Ƃ��Č�������w�}�`���͓�����ƂɂȂ�܂��B���̌��ʔ��F��c�̐����A���~�j�E���ȂƔ�ׂď��Ȃ��̂Ŕ��א����F�߂���̂ł��傤�B
�ԐM�@���{�݂��a�������Ǖ���iEVG�̃T�[�x�C�j�ȗ��A�V���E�X���b�h�����Ďg�p���Ă��܂��B���{�݂ł̓V���E�X���b�h����ꂽ�̂Ɠ���Ȃ��̂ł́A�ԐF�̑N�₩�������炩�ɈႢ�܂��B�������A�搶�ɂ��D�]�ł��B����b���������G�I�W�����t���L�V��������Ă��܂��B
�ԐM�@�V���E�X���b�h�ł����A�a�������Ǖ���̎��ɂ�17�{�ݒ�2�{�݂̎g�p�ŗ����Ƃ�A�i�_�t�N�V���g�p�{�݂͑S��B�j�ł����B��N�̌����x�Ǘ������ł�37�{�ݒ�2�{�݂��V���E�X���b�h�P�Ǝg�p�A5�{�݂��_�t�N�V���Ƃ̍����g�p�ł����B7�{�ݒ�1�{�݂�B�]���ł������ȊO�͑S��A�]���ł����BA�]���͑S����9�{�݂������̂ŃV���E�X���b�h�g�p�{�݂̕]�����ɂ߂č����̂������I�ł����B���F�����܂��{�݂��V���E�X���b�h���g�p���Ă���̂��V���E�X���b�h���g���Ɨǂ��Ȃ�̂��Ƃ����^�₪���邩�Ǝv���܂����A�a�������Ǖ���̎��Ɏ_�t�N�V���h�ł������̂������x�Ǘ��������ɂ̓V���E�X���b�h�ɏ�芷�����{�݂�5�{�݂���܂������A���̓�4�{�݂�B�]������A�]���ɕς���Ă��܂��B����͂���Ȃ�ɈӖ��̂��邱�Ƃ��Ǝv���܂��B�V���E�X���b�h�͐ԐF�̑N�����������ł����A���e�͈͂̍L�����������Ǝv���܂��B�_�t�N�V���̓s�N�����_�Ƃ̍����䂪�����ŏ����ł����Ȃ��ƐԖ�������Ȃ��Ȃ�A�����ł������ƐԂ����Ԃ��Ă��܂��܂��B�V���E�X���b�h�͂��̓_���������Ă����Ԃ肪���Ȃ��A�������e�Ղȓ_�����F���x�ȏ�ɗL�p�ȂƂ��납�Ǝv���܂��BEVG�̐��F�͂قƂ�ǂ��̃����M�[�\���̒����ɂ������Ă���Ƃ����Ă��ߌ��ł͂Ȃ��̂ŁA�����̔��������ȒP�ȕ������x�Ǘ������Ă�����ł̗͊v���Ǝv���܂��B
�ԐM�@�����A���ۂɎ��p���Ă݂܂����B�a���Z�t�I�ɂ͑喞���Ȃ̂ł����A���ȏ��I�ɂ͍����Ƀ����M�[�\���͎_�t�N�V�������AHE�̓G�I�W���݂̂������悤�ȋC�����܂��B�ŐV�̋��ȏ��͂�����ƒ��ׂĂ͂Ȃ��̂ł����E�E�E�B�܂�A������ɂȂ�̂����悭������Ȃ��̂ł��B���܂����ŗǂ��̂ł��傤���B�����t���L�V���Ɋւ��Ă͓��ꂽ�ق����ǂ��悤�Ɏv���܂��B�P�ꕪ�q���g�p������́A�l�X�ȕ��q�ʂ̂��̂������Ă����ق������ʂ������悤�ȋC�����܂��BEVG�ɂ����Ă��V���E�X���b�h(sirius
red F3B C.I.Direct Red 80 M.W. ?)�͎_�t�N�V����薾�炩�ɏd��(���q�ʂ��킩��Ȃ��̂ō\�������݂����)���q�ł��B���F�������Ȃ邽�߂ɍׂ��P�����ۂȂǂɋz�������Ƃ��ɐԂ����������Ǝv���܂��B�������abs�̈Ⴂ�͂���܂����E�E�E�B�܂�E�E�E�B�P�����ۂ���߂���F�Ȃ�A�P�����ۂ���߂邱�Ƃ��ړI�ł��ꂪ���܂�߉��F�f���g���āA����P�����ۂ����������̂ł���A�ǂ����Ƃ��Ǝv����ł��B�ł��A��Ƃ������E�E�E�B�����������̂��A�ז������Ă����������ɓ��ݐ�Ȃ����ł��B�֑��ł��@���i�A�n��̐��x�Ǘ������Ă��Ďv���̂ł����A���w�n�̐��x�Ǘ��ɂ͊�ƂȂ�W���t�Ȃ���̂����݂��A���ΓI�ȕ]�������ΓI�ȕ]���Ɉڍs������܂��B�ۂȂǂ̏ꍇ�ɂ́A���Ɛ��̔|�n���g�p���Ă��̔|�n�ɋۂ��͂��Ȃ���Εa���ۂȂ��Ƃ������ƂɂȂ�܂��B�������Ȃ���A�s�̂̔|�n���g�p����Ǝ��ۂɂ͋ۂ����炵�Ă���Ȃ�Ă������Ԃ��}�}���݂��܂��B�O�����x�Ǘ����s���Ă��Ȃ��{�݂ł́A�����Ȃ��āA���ʉA���B�ł��s�̔|�n���g���Ζ{���͐�����B����Ȃ��Ƃ����ۂɂ͋N���Ă��܂��B�܂�A���̎��Ɛ��|�n�̕i���ۏ͊O�����x�Ǘ����s���Ă��Ȃ��{�݂ł͕ۏ���Ȃ����ƂɂȂ�܂��B���l�ɁA�a���̏ꍇ�Ɏ��Ɛ��̐��F�t�̕i���ۏƂ����̂͊O�����x�Ǘ����s���ȊO���肦�Ȃ��Ǝv���Ă��܂��B�K���Ȃ��Ƃɕa���̏ꍇ�ɂ͂�����x�̕i�����ۂĂȂ����F�t�͖ړI�������܂�Ȃ��̂ŁA�����������ƂɋC�Â��܂��B���A�]�����ł��Ȃ��Z�t���s���ۂ̎���Ɠ��l�̎��Ԃ��N���蓾�܂��B�����ǂő����Ă��鐸�x�Ǘ�����ՋZ���s���Ă���O�����x�Ǘ��́A���̎{�݂̃N�I���e�B�̕]���ł���A���̏d�v�����q�V�q�V�Ɗ����Ă��鎄�ł��B
�ԐM�@������ς茤�C��Ȃǂ̐��ʂł��傤�B�����O����w��A���C��Ȃǂł��炿��͂���܂������A���̃��x���łƂǂ܂��Ă����̂ł����ˁB�����������w����s�̕i����������Ă��邱�Ƃ���A���܂ł�����Ȃ�̎��v�͂������̂ł͂Ȃ��ł��傤���B
�ԐM�@���V���E�X���b�h�P�Ƃ�2�{�݂ɁA������5�{�݂ł��B
�����@�Ȃǐg���{�݂������ł��ˁB�P�Ǝg�p�ƍ����g�p�Ŋi�i�ɈႢ�͖��������悤�Ɏv���܂��B�����P�Ǝg�p�̕����F���������u���I�����W�F���������悤�Ȋ����ł��ˁB�l�I�ɂ͐Ԃ������Č�����P�Ǝg�p�̕����D���ł��ˁB
�ԐM�@�����t�Ŏg���j���[���`�����u���[�̗l�ɐ��זE�ł��e�ՂɍזE����ʉ߂����F����F�f������܂����A�啔���̐F�f�͐��זE�ł͐��F����܂���B�זE������őI��I���ߐ���������ƁA�זE���ɐN�����Ă����܂��B����ɃA���R�[����z���}�����ŌŒ肷�邱�Ƃɂ��A���̈ꕔ������ꂽ�薌�ђʃ^���p�N�Ȃǂ��ό`���Ă�����₷���Ȃ�܂��B�E�ʊ����܂�p����Ɩ��ђʃ^���p�N���n�����Ė��Œ�ł����Ȃ�ʂ�₷���Ȃ�܂��B
�ԐM�@������߂��d���̑����݂�ƈ�ڗđR�ł��ˁB�זE�����\������e���a������L����ɐ������̓q���Ɩ��`���Ƃ����邩�Ȃ�傫�Ȓ`��������\������Ă��܂��B�悭���ȏ��ɍڂ��Ă���Singer, Nicolson�̗������U�C�N���f���͒��L���ł��B���̓�(�������w�I�ȉe������O)�ł͂��̖��\�����j��Ă��Ȃ����߂ɐF�f���q���זE���ɓ��荞�ނ��Ƃ��ł��܂���B�������Ȃ���A�z���}�����t�A�A���R�[���܂��͐��Ȃǂ̕����ɂӂ��ƁA���̖��\�����ۂĂȂ��Ȃ�܂��B�����炭�A�זE���`�����������q���̕����ア�Ǝv���A�זE���`�������͂ɂ���炪�ւ�t���l�q���z������܂��B�z���}�������ɂ��炳�ꂽ��̍זE���́A���Ƃ��������Ԃɋ߂��\���ɂȂ��Ă�����̂ƍl�����܂��B���̖Ԃ̖ڂ́A�F�f���q�������Ȃ�傫���A�F�f�͍זE���O�����R�ɒʉ߂ł���ƍl�����܂��B�ł͊j�݂̂����̐��܂�̂ł��傤�B�����ɂ́A�j���̍\���ɔ閧������܂��B�j���͖��x�̍����\���̂���Ȃ�A����́A�����x�̂��߂ɐ����ɑ��Ĕ�r�I����Ȃ̂ł͂Ȃ����ƍl�����܂��B�A���̍זE�͍זE�����j��A��Ɋj�̔j������܂��B����́A���̂��Ƃ𗠕t����؋��ɂȂ�̂ł͂Ȃ����ƍl�����܂��B�Ɠ�������܂������A�C���[�W�Ƃ��ẮA������߂�Ƃ������̓l�b�g(��)����߂Ă���Ƃ����T�O�̂ق������߂��̂ł͂Ȃ����Ǝv���܂��B���������ɖڂׂ̍����ԔZ�������Ƃ����Ȃ�A�זE�����Ƀw�}�g�L�V���������܂��Ă���悤�ȍזE�������Ă�������������܂���ˁB�E�ʊ����܂�p����Ɩ��ђʃ^���p�N���n�����Ė��Œ�ł����Ȃ�ʂ�₷���Ȃ邱���́A�E�ʊ����܂ɂ���āA�ɐ������̑a�������e�������Ă��܂����߂ɂ�������̂Ǝv���A�����q���̔j��������N�����Ă�����̂ƍl�����܂��B�����������i���F���Ă�����̂́A���ł͂Ȃ��A���������c�����ɑ��ĐF�f�����Ă���ƍl�����ق��������ɍ����Ǝv���܂��B
�ԐM�@���\�ʂ��M�g�M�g���Ă����ł����ˁB�m���ɂ��܂Ɍ��܂��ˁB�����C�ɂ��Ȃ��Ŏg���Ă܂��B�i�j�G�I�W���x�ɂ͏L�f���̏��Ȃ��s������t���I���b�Z�C�����������Ă��āA���_�����邱�Ƃł���炪�������ďo�Ă��܂��B�L�f���̏��Ȃ��s���������a���āA�t���I���b�Z�C���̗l�Ȍu���F�f���\�ʂɕ����̂��Ǝv���܂��B�����l�i���O���j�ɂ��炷�Ƃ����������u���F�f��������܂��B�܂������鉖�_�̗ʂ���������̂�������܂���B�������w����s���A�G�I�W���Ƃ������炩���ߕs�������������G�I�W�����̔�����Ă��܂��̂ł�����g���Ɨǂ���������܂���B
�ԐM�@������Ǝ��Ԃ������Ē��ׂȂ��Ɖ�����Ȃ��̂ł����A�����ߒ��ɐ�����s�������ƍl�����܂��B���ꂪ�����Ƃ����Ƃ��낢���肪�����܂����E�E�E�B���Ȃ݂ɁA���̃G�I�W���̓����N�Ђ̐��i�ł��傤���B�����m�̂悤�ɐF�f�͐��������Ђɂ��A���̐����H�����قȂ�܂��B���o��ƂŐ�����L�@���̗n�}������������Ȃ������x���[���ނȂ̂�������Ƃ悭�킩��܂���B�������猟���Ă݂�ƁA�܂������y�������ł���B�F�͂����������s���N�E�I�����W�������悤�ɋL�����Ă��܂��B��ʓI�ɐF�f�Ƃ������́A���x�����܂�悭�Ȃ����̂������悤�ł��B(����������Ƃ��ꋉ���Ȃ�?)�@�s�������܂߂ĐF�f�ƍl���Ă��ǂ���������܂���ˁB
�ԐM�@�J���~���̓R�`�j�[���Ƃ��Ă�A�����A�����J����ѓ�A�����J�̍����n�тɔɂ�T�{�e��(opuntia)�ނɊ���G���W���V�̈��coccus cacticoccinelifera L.�̎��Ɋ܂܂��g�F�̐F�f���瓾���܂����B�ʏ�M���ɂ��G���W���V�̒��o�����H�ɂ���Ē��a���������̂��J���~���ł����āA���̑g���̓J���~���_(carminic
acid C22H20O13)�ƃA���~�j�E���A�J���V�E���A�`�����Ȃǂ̌�������Ȃ��Ă��܂��B�]���āA�F�f�̐���ɂ͎���̍����ɂ���āA���Ȃ�̍��ق��łĂ��܂��B"carmin
nacarate"�ƌĂꂽ�A���������e�Ղɕ���ɂ�������y���F�f�́A�ō����i�Ƃ��đg�D�w��ōD��ŗp����ꂽ�悤�ł��B�܂��A�J���~�������߂ē����g�D�̐��F�ɉ��p�����̂�Corti(1851)�ōזE�j�̐��F�ɗp�����܂����B�������A�A���זE�ɂ��Ă�Goeppert
u. Cohn(1849)�����łɃJ���~���𗘗p���Ă�����ł��ˁB���̌�J���~���́A�x�X�g�̃J���~���A���`�J���~���Ȃǐ��������p���ꂽ��ł����A�߂������ȍ����ł͐l�H�I�F�f�A�Ⴆ�A�]�J���~���A�P�����G�q�g�ԁA�_�A���U�����Ȃǂɂ���đ�p���ꂻ�̗��p���l�͒������ቺ����������Ɩ{�ɏ����Ă���܂����B�ȑO�ɂ���������ł����E�E�E�B�G�I�W���̗��j�ɂ��ẮA������w�̎��Ƃōu�t�̐搶���班�����������x�Ȃ̂ł����A�G�I�W���́A�ԃC���N�̌����Ƃ��ĊJ������Ă��ƕ����Ă���܂��B�G�I�W�����o�ꂷ��O�܂ł́A�痿�n�̐ԃC���N(���@������)����̂ł����B�J���҂̎������Ж��͖Y��܂������A�e���|�����������ǂ����E�E�E�肩�ł���܂���B�����Ƃ��Ă͗L�@�ޗ��ŐԐF��悷����̂͑��݂��Ȃ������̂ŁA�L�@�����ɂ�蓾��ꂽ�G�I�W���͓����Ƃ��Ă͍Ő�[�̐F�f�������̂ł��傤�B�����āAHE���F�ɃG�I�W�����g�����Ƃ������Ƃ͔��ɍŐ�[�̐F�f���g�p�����\���������Ǝv���܂��B���Ȃ݂ɁA�C���N�Ɏg���Ă���F�f�ł�����L���ȐF�f������܂��B����̓t�F���V�A�����J���E�����g�����x�������F�f�ł��B�S�𒆐S�Ƃ������̐F�f�͔��Ɉ���ŁA���O���Ȃǂ̌����w�����ɑ��Ă����ɋ�������������܂��B�i�v�Ɏc��������T�C���ɂ͍D��Ŏg�p����Ă����悤�ł��B�悭�������Ȃǂ̏�ɖ��N�M�Ŏ��T�C�����Ă��܂���ˁB���̃C���N�ɂ́A���̐F�ێ�������x���������g�p����Ă���悤�ł��B�����āA���̃t�F���V�A�����J���E���ł����A���w�\�������ɕ��G�ō\������͎��}�͕`���Ȃ��ƌ����Ă��܂��B���̒��ɂ́A�������Ă���悤�ʼn������Ă��Ȃ����̂��Č��\������ł���ˁB�֑��ł����A�����w�����ɑ��Ă����Ƒϐ��������̂́A�R�o���g���̂̉������ł��B���̐������瓌�C���V�����̃{�f�B�[�̐F�ɂ́A���ꂪ�g���Ă��܂��B���{���ւ�Ő�[�Z�p�̌����ł���V�����ɂ́A��͂�{�e�B�[�J���[�ɂ��ō��̂��̂��g���Ă����ł��ˁB�G�w�̂悤�Ȃ��Ƃ���Ő\����܂���B�G�I�W���̍������@��s�����̑g���A�Ȃ�тɃG�I�W���a���̗��j�ɂ͔��ɋ���������܂��B���ȏ��ɂ����܂�G����Ă��܂���ˁB����Ƃ��A���̌��͒ǐՒ����Ƃ��Ă����Ԃ��������������ł��B���낢��ȏ��Ԃ��璲�����Ă݂����̂ŁA���肢���܂��B�܂��A�������|�[�g�͐������̃��[�����O���X�g�ɃA�b�v���܂��B
�ԐM�@�ȑO���̉�Łu�G�I�V���̗R���ɂ��Ă͕s���m�ł���A�ǐՍ��ڂƂ����Ă��������v�Ƃ̋L�ڂ��v���o���ǂݐi�߂Ă����ƁE�E�E�E�B1871�NBaeyer���s���K���[������t���I���V�������������B���̃t���I���V�����獇�����ꂽ���̂��G�I�V��A�ł���Ƃ����L�ڂ�����܂����B��͂�A�G�I�V���͍����F�f��������ł��ˁB�t���I���V������G�I�V�������ɂ��Ă̏ڂ����L�ڂ͂���܂���ł������A���̖{�ɂ͉���t�N�V���̍������@�₻�̑��̐F�f�̍������@���L�ڂ���Ă��܂����B�܂��A\200�ōw�������{�ɂ��ẮA���ɂƂ��Ċy�������e�̂��̂ł����B���Ȃ݂ɖ{�̖���TITLE:
TEXTBOOK OF ORGANIC CHEMISTRY 1951, EDIT: FIESER & FIESER (�v�w�ł̒����̂悤�ł�)MARUZEN
CO., LTD
�ԐM�@���}���i�����^���O�X�e���_+���������u�e���_�j�̎��Ԃ��Z���Ɗj���Ԃ��Ȃ�l�ł��ˁB���Ԃ������Ȃ�ƃA�j�����̐��F����������Ƃ������Ƃł����A�A�j�����͂ǂ��炩�Ƃ����Ƒ������܂��Ď~�߂�|�C���g������̂ŁA���}���̎��Ԃ��������Ƃł��ꂪ���~�߂₷���Ȃ����������ȁB��̖̂{�ɂ�1�����Ȃ��悤�ɂƏ����Ă��邪�A1-2�����炢�͕��C�������悤�ȋC�����܂��B�i�ۏȂ��j
�ԐM�@�����炭�A�C��������Ȃ���Ȃ����Ɨ\�z����܂��B����������႟��������!!!����Ȋ����ł��B
�ԐM�@�������Q�}����(�����^���O�X�e���_,���������u�f���_)�̖�ڂ��l�@���Ă݂����Ǝv���܂��B�����^���O�X�e���_�̓^���O�X�e�����܂ޑ傫�ȉA�C�I��(-)�����̂ł���A��������(-)�A�j�����̂悤�Ȏ_���F�f�Ɠ������w�I�����������Ƃ����Ă��܂��B�o���I�Ȃ��Ƃ����P�����ۂȂǂ̒`�����Ƃ̌������̓����^���O�X�e���_
< �A�j�����Ƃ������Ƃ����@����܂��B����̊j�̐Ԑ����l�@�����ŁA���̂��Ƃ����ɏd�v�ł���Ǝv���܂��B�����^���O�X�e���_��������u�f���_���g�p���闝�R�Ƃ��ẮA�����̕������g�����ƂŐԐF�F�f�������̒`�����ƌ��������Ȃ���p�������܂��B�܂�A�����d�C�͂������������^���O�X�e���_����у��������u�f���_���A�ԐF�F�f�ƒ`�����Ƃ̌������ז����ċ�����A���̕����ɂ͐ԐF�F�f�������ł��Ȃ���Ԃɂ��邱�Ƃł��B�܂��A�����̒`�����Ƃ́A�A�~�m��[-NH2]��L���郊�W����A���M�j���Ȃǂ̃A�~�m�_�𑽂��܂ޒ`�����̂��Ƃł��B�j���̐ԐF���F�̓|���\��_�t�N�V���Ȃǂ��j���ɂ��邱���̃A�~�m�_�ƌ������Ԃ���������̂Ǝv���܂��B����A�j����߂�w�}�g�L�V�����͊�{�I�ɗ��_��[-SO4(-)],�����_��[=PO4(-)],�J���{�L�V����[-COO(-)]�Ȃǂƌ�������̂ŁA�ԐF�F�f�Ƃ͈Ⴄ�A�~�m�_����ђ`�����ɒ��F���܂��B�܂�A�����^���O�X�e���_��������u�f���_���g�p�Ȃ��ꍇ�ɂ́A�����̐F�f���z�����Ă��܂��A�ԐF�F�f���ڗ��Ƃ������ʂɂȂ�܂��B���ɁA�w�}�g�L�V�����ƐԐF�F�f�̑傫�����r���Ă݂܂��傤�B�w�}�g�L�V�����E�P���a���@(MW.
320.3)�|���\2R (MW. 480.4)�_�t�N�V�� (MW. 585.5)�ƂȂ�A�w�}�g�L�V���������傫�ȕ��q�ł��邱�Ƃ�������܂��B�g���Ȃǂ����čl����ƁA�傫�ȕ��q�̂ق�������ł͊m�F���₷���Ƃ�������������܂��B����āA����̂悤�ȐԐF�̃w�}�g�L�V���������������ꍇ�ɂ́A���q�ʂ̑傫�ȐԐF���ڗ��Ƃ������ʂɂȂ�܂��B�����^���O�X�e���_�ƃ��������u�f���_�̍�p�̈Ⴂ�ɂ��ẮA�ǂ��炪�ǂ̂��炢�דd��Ԃ��傫�������͂悭������܂���B�������您�m�点���܂��B�܂Ƃ߂�ƁA��Q�}�����g�p���闝�R�Ƃ��āA�j���̌�ɁA�j���ɑ��݂���ԐF�F�f�ƌ�������`��������уA�~�m�_�Ƌz�����āA�ԐF�F�f�����Ȃ��悤�ɂ��邱�ƂɂȂ�܂��B�}���Ƃ����\�����ǂ����������͕s���m�ł����A���܂�ǂ��\���ł͂Ȃ��悤�Ɏv���܂��B
�ԐM�@���̈ꎞ���r�N�g���A�ɋÂ��Ă��鎞��������܂��āA���낢��Ȑ��F�Əd���F���Ċy����ł��܂����BHE�Əd�˂�ƃ����n���������Č��h���̂�����F�ɂȂ�܂���ˁB�����܂�w�}�g�L�V�����̐��F�����ቺ�����Ƃ����������Ȃ��ł����A���������o�����������g�o�����Ȃ��ł��ˁB�w�}�g�L�V�����Ƒ����������Ƃ������͂Ȃ��ł����ˁBGM�w�}�g�L�V�����Ƃ����̂̓M���̕ϖ@�ł��������H�B���߂Ɂi�����j���߂ĕ��ʑ�����s���Ă����߂ł����ˁB���G�I�W���̐��F�����ቺ����Ƃ����L�q���Ȃ��̂Ŏ_�������͂��Ă��Ȃ��Ɛ��@���܂��BPAS�p�̉߃��[�\�_�ł�����Ǝ_�����Ċj�̐��F�����グ��Ƃ����������܂����A���U�@�ł͂Ȃ��ł��ˁB���r�N�g���A�u���[���F�t���_���n�t�Ȃ̂Ŋj���^���p�N�������܂�_���ɌX���߂��Ă���ƃw�}�g�L�V�����ɐ��܂�Â炭�Ȃ鎖�͍l�����܂����A���ʐ��͏\���ɍs���Ă���̂ł���ˁB���̂Ƃ��낱�ꂭ�炢�����v�������т܂���A�����������F���@���ڂ��������Ă�������Ɖ����肪���肪���߂邩������܂���B
�ԐM�@���{�݂ł���p�ޗ��Ɋւ��Ă�VB�������Ă���܂��B������HE���F�̐��܂肪�������͂���܂���B�m���Ƀ}�N���Ō���ƐF�������悤�ɂ݂͂��܂����A�������Ō������ł͖�肠��܂���B���Ȃ݂�VB�͕������w�̂Q�T�ԏn���ς݂łQ���Ԑ��F���Ă���܂��B�w�}�g�L�V�����͎��ƒ����̃}�C���[�ŃG�I�W���͐���b���������G�I�W�����g�p���Ă��܂��B���F�̒ቺ�̓����ɂ͂Ȃ��Ă܂��Q�l�܂łɁB
�ԐM�@���̎{�݂ł��ȑO��VB+HE���F���s���Ă��܂����B�������A�����A�E���ď������Ă���~�߂܂������E�E�E�B���̂Ƃ��̋L���ł��A�m���Ƀw�}�g�L�V�����̐��܂�͂Q���`�R�����Ƃ��������F���ł����B���́A�������܂�ǂ����F�ł͂Ȃ��Ȃ��Ǝv���Ďd�������Ă����悤�ɋL�����Ă��܂��B���āA���̌����͂Ƃ����ƁE�E�E�B���@�̏ꍇ�ɂ͎_���Ҍ��̍�Ƃ��s���Ă������ƂɋN�����܂��B�r�N�g���A�̐��F�̐��F�����ɂ��Ă͍��Ȃ��s���ȓ_�������悤�ł��B�r�N�g���A�P�̂ł́A�G���X�`�������܂邱�Ƃ�1886�N�ɕ���Ă��܂��B�܂��A����t�N�V���Ȃǂ����l�ɃG���X�`���ɐ��܂�ƋL����Ă��܂��B�l�I�ɂ́A���̑��̓����̈�Ƀ��]���V���̑��݂��������܂��B�e�����ۂ���߂���F�ɂ̓��]���V���t�N�V���Ƃ������̂�����܂����A���F�̋@�\�͎����悤�Ȃ��̂ł͂Ȃ����Ǝv���Ă��܂��B���]���V���̍�p���𖾂��邱�Ƃʼn��炩�̌����������邩������܂���B�p�������Ƃ������܂��B�ŁA���������������Ƃ����ƁA�e�����ۂ���߂郌�]���V���t�N�V���ł͎_���Ҍ��̑�����s��Ȃ��̂ɁA�Ȃ���VB�ɂȂ�Ƃ��Ƃ����{�݂��݂���_�ł��B�������A���ȏ��I�ɂ͎_���Ҍ�������悤�ɏ����Ă�����̂��������݂��܂��B�������Ȃ���A"�a���ƗՏ�"��"�V���F�@�̂��ׂ�(���u�c�E��̕�)"�ŁA�Љ��Ă�����@�ł͎_���Ҍ��͍s���Ă��܂���ˁB�܂�A�_���Ҍ��̗L�p�������ɂȂ��Ă���킯�ł��B�_���Ҍ����s��Ȃ���A�����炭�w�}�g�L�V�����̐��F���͕ۂ����Ǝv���܂��B�܂��A���F���ԂȂǂɂ����Ǝv���܂����E�E�E�B���Ƃ��ƁA���̐��F��-S-S-���-SH����܂ރV�X�`����V�X�e�C������߂���̂ł��B���ړI�Ɏ_���Ҍ��ɂ���Đ��F�����]�X�Ƃ������́A�ނ��낻�̑��̕������������邱�Ƃ�}�������葝�������肷��v�f�������̂ł͂ƍl���Ă��܂��܂��B�^�U�̂قǂ͒肩�ł͂���܂��E�E�B(._.)VB�͉t�̒���������A���]���V���̐V����F�f�̏��x�Ȃǂɂ���Ă������e��������܂��B���肵�����F�������̂ł���A�s�̕i���g���Ă݂�̂��肩������܂���ˁB�������F�����������t���g�p����ƒe�����ۂ��ǂ����܂�܂��B�߃}���K���_��N�����_�Ȃǂ͎_���͂����ɋ������̂ŁA����̂悤�Ɋj�̐��F���������錴���Ƃ��ċ��炭�j�`�������\�����郊���_��܂ł����_�����Ă��܂��w�}�g�L�V�������z�����ɂ����Ȃ��Ă��܂����\�����l�����܂��ˁB�܂Ƃ߂�ƁA�Ώ����@�Ƃ��ẮA1.�_���Ҍ���Ƃ��s��Ȃ��Ő��F���Ă݂�B2.�ǂ����Ă��s���ꍇ�́A�_���Ҍ����Ԃ�Z���Ԃɂ��邩��������̂����悤�ɉ߃��E�f�_�Ȃǂ̎ア�_����p�̎_���܂��g�p����B3.���܂肪���肵�Ă���s�̂�VB(����)���g�p����B�Ȃǂ��������܂��B���}���E�E�E�B
�ԐM�@�������@�Ƃ��ẮA��������̌����邱�Ƃʼn��������Ǝv���܂��B�r�N�g���A�́A�I���V�A�����獇�����ꂽ�Ԋ��F�������ŁA���ɕs�n�A�A���R�[���ɉn�̉���F�f�ł��B�g�a�����F�ɂ́A�_����v���܂����A�e�����ې��F�ɂ͕s�v�ł��B�i�_�����邱�ƂŒe�����ۂ̂r�r��A�r�g��Ɛ��F�t�̌����������Ƃ����Ă��܂����j�Q�l�F�����ƋZ�p�@������.26�@no.7�@1998�N�@�������A�e�����ۂ̐��F�@�i�R�����j��114-118�܂��A�_���܂��߃}���K���_�J���Ɨ��_�̍����t�ł�����A�j���̊j�_�A�ӎ_����_������Ă��܂��A�j���F�����F���ɂ����Ȃ�܂��B�܂��A�e�����F�t�i�I���Z�C���A���]���V���E�t�N�V���A�u�a���j�́A�����������F�f�ł���A�i���Ȃ݂Ƀw�}�g�L�V����������F�f�j�A�����͊j�ɂ����܂��Ă��܂��̂ł��B�]�k�ł����A�����̐��F�t�͎_���S�t�i�X���z���`���j�����F���܂��B���F�菇���炵�Ă��A�u�a���F����ł��邽�߁i�_�������Ȃ��j�A���܂�ڗ����܂��j�ɂ����܂��Ă���̂ł��B���������āA�@�@�u�a���F���70%�A���R�[���̕��ʏ����͏\���ɍs���j�ɋ�������Ƃ��́A�P�����_�A���R�[���ŏ\���ɕ��ʂ���j�A�@����������\���ɍs���i�T���j�B�@�g�d���F����悢�Ǝv���܂��B�ȏ�ł��B
�ԐM�@�_���Ҍ��͂��Ă���̂ł���?VB�͂������������g�p���Ă��܂����A�܂���肠��܂���ˁB���i�Ƃ������Ƃňꉞ�i���Ǘ����ł��Ă���悤�ł��ˁB�ȑO�A���Ɛ�������Ă��܂������A�V�����F�f�����܂�悭�Ȃ��āA�����i�ɂ��܂����B�����́A�e�����ې��F��EVG�ł���Ă���̂�VB+HE�͍s���Ă��܂���B������A���i���Ă����܂茸�炸�A�Ȃ�ƃR�X�g�p�t�H�[�}���X�̍������F�t���ƁA���S���Ă���܂��B
�ԐM�@���@�ł��A�ȑO�͐��߂Ă��Ȃ������̂ł����A��͂薬�ǐN�P�������₷������ƌ������ƂŐ��߂邱�ƂɂȂ�܂����B�w�}�g�L�V�����̐��܂�́A�u���Ȃ�v�ƕ\�����Ă��܂��܂������A�Q�`�R�������x���Ǝv���܂��B���̐��F���@�ł����A�_���Ҍ�����͍s���Ă��܂���BVB�̐��F�t�͎����Œ������Ă��܂��B�i2�T�ԏn�������Ă���g�p���Ă��܂��B
�ԐM�@2���Ԑ��F��A70���A���R�[���ŏ\�����ʂ��Ă��܂��B���̌�A�f�l�w�}�g�L�V������8���i�ʏ�g�d�ł�5���j���߂Đ��A�s���A�E�G�I�V���i���t5�{��߁j��5�����߂Ă��܂��B�w�}�g�L�V�����ɒ��߂ɓ���邱�ƂŊj�͐��܂��Ă����̂ł����A�G�I�V���̐F�������Ȃ��Ă��܂��܂��B�����ŁA�v������12�����炢���ꂽ���1�����_70���A���R�[���Ōy�����ʂ��Ă݂�ƁA�G�I�V���̐F�͗ǂ��Ȃ����̂ł����A�j���ڂ₯�������ɂȂ��Ă��܂��A�V���[�v���Ɍ�����C�����܂��B��������̂��������l�ɁA�j��VB���������Ă��邹���ł��傤���H�w�}�g�L�V�����̑O�̉��_�A���R�[���̕��ʁA���������Ă݂悤�Ǝv���܂��B�w�}�g�L�V�������ς��Ď����Ă݂܂��B�����݂́A�ǂ�������F��HE���C�ɓ���Ȃ��̂ŁA�S����HE�{������VB�EHE���Z�b�g�ŏo���Ă��܂��B�ł����A�ŋߐ搶�ɁuVB�EHE�݂̂ł悢�̂ł́H�v�ƌ����A�Y��ł��܂��܂����B�Ȃɂ��A�����Ŗ{��Ў�Ɏn�߂����F�Ȃ��̂ŁA�S�z�Ȃ̂ł��B�_���Ҍ��ł����A���p�������Ȃ���A�{�Ɂu�����M�[�\�������d���F����Ƃ��͎_���Ҍ��͂��Ȃ������ǂ��v�Ə����Ă�����������Ȃ������悤�Ɏv���܂��BVB�E�����M�[�\�������ꂢ�Ȑ��F���Ǝv���܂��B���̏��ł́A�uEVG�v�����e�����ۂ����₷���ƍD�]�ł��B
�ԐM�@�Ȃ�قǁA�ł͘b���ς��Ă��܂��ˁB�_���Ҍ����s���Ă��Ȃ���A���̌����ɂ��Ă�VB�̐��F�t�ɖ�肪���肻���ł��ˁB�s�̕i���g�p���Ă��遛������̎{�݂ł́A���Ȃ��Ƃ����������Ă��܂��̂Ŏ��Ɛ�VB���F�t�ɍi�邱�Ƃ��ł��܂��ˁB�l�����錴���Ƃ��Ē������Ɏg�p���鉖�����S�̑��݂����₵���ł��ˁB�r�N�g���A�͉���t�N�V���Ɣ��Ɏ����\����悵�Ă��܂��B���F�̖ړI���������l�ł���A���]���V���t�N�V���Ɠ��l�̐��F�������l�����܂��B���݁A���]���V���t�N�V���ɂ����Ă��A�l�X�Ȍ����������Ă��܂����A�������S�ɂ�鉖��t�N�V��(�r�N�g���A��)�̎_���I�F�f�d���ɂ�苤�v�n���L�тċ��剻�����F�f���q�Ƌɐ���̖R�����G���X�`���Ƃ�Van
der�@Waals�͂ɂ����̂Ƃ������݂Ɋ�Â��Ȃ�A���F�t�̒����ߒ��Ŗ{���F�f�Əd�����ׂ��������S���������̂܂c�����A��������������܂��B���ꂪ�A�A���R�[���ŗn���������F�t���ɍėn�����A���F�t���ɂ͗V���̓S�C�I�����������݂��邱�ƂɂȂ�܂��B�S�C�I���Ɋւ��ẮA�j�`�����Ƃ̌��������A���~�j�E�����������A�����͋��ł��ƌ����Ă��܂��B�܂�A�S�C�I���܂��́A�P�̂̓S-�r�N�g���A�F�f���j�`�����Ɍ������Ă��܂��A��ɐ��F����w�}�g�L�V�����̊j�ւ̋z����j�Q���Ă���\�����l�����܂��B�Ώ����@�Ƃ��āA���F�t�쐻���̔����n�̎��Ԃ����Ė����������̎c����}������B���ƁE�E�E�A���F�t�쐻���̔����F�f������A�v�������ďォ��������������ė]���ȕ���(�������̉������S�Ȃ�)���Ă��܂��Ȃ�Ă��Ƃ��l�����܂��ˁB�r�N�g���A�̐��F�t�̒����͍H���������A�ړI�����̎��������Ȃ舫���Ȃ��Ă��邱�Ƃ��l�����܂��B���Ɛ��ɂ������̂ł���Ύ������グ������ʼn��炩�̎藧�Ă�łK�v������܂��ˁB���i�Ƃ��Ĕ����Ă�����F�t�͐F�f�̏d����(���ʑ�)�̏��x�������A�P�ʑ̂�t���[�̓S�C�I���Ȃǂ̑��݂���ɏ��Ȃ����邱�ƂŐ��i�̕i����ێ����Ă�����̂Ɨ\�z����܂��B�������i�̐����҂Ȃ���̂悤�ȕ��@�Ő��i���쐻����ł��傤�B(^_-)�܂��A�r�N�g���A�t�Ɋ܂܂�Ă��镨���ɂ̓f�L�X�g�����A���]���V���Ȃǂ�����܂����A�����̓����ɂ��Ă͌p���������ł��B�����A���]���V���Ɋւ��Ă͐F�f�����ʑ̉�����Ƃ��̐ڒ��I�v�f������̂��Ȃ��A�Ȃ�čl���Ă��܂��B����Ȃ��Ƃ��āA�Q�l�ɂȂ�̂��Ȃ�?
�ԐM�@����A��������Ɠd�b�ł��b�������̂ł����A���̂Ƃ�VB�̘b��ɂȂ�܂��āA70%�A���R�[���ł̕��ʂ�����������Ɗj�̐��F�����ێ������Ƃ����܂����B�ł͂ł͂��Ǝ��ۂɍs���Ă݂܂����B�A���R�[�����ʂł̃A���R�[���������R��ɂ��ĐF���قƂ�nj����Ȃ���Ԃɂ����߂ɐZ���Ă����܂����B���̌�A����(��������)�����ĒY�_���`�E�������E���_�i�g���E�������E�����Ȃ��EHE�݂̂Ɗe�Q���Â������Ō�HE�������Ȃ��Ă݂܂����B���ʂ́A�ǍD�ł�����BVB�������s�������̂Ɋւ��Ă͏����@�ɂ�荷�ق݂͂��܂���ł����BHE�݂̂̂��̂Ɣ�r����ƃw�}�g�L�V�����̋��x�͂قƂ�Ǎ����ł܂���ł����B�ނ���AVB�����̂ق��̓G�I�W�����J�u���C���ŔZ�����F��悵�܂����B�܂��A�������������Ă��Ȃ��̂Ńn�b�L���Ƃ͌����܂��A�悳�����Ȉ�ۂł���B
�ԐM�@���z���c�A�[�͓�������B�I�]���łȂ��{�݂������Ў�ɂ�����̂ł͂Ȃ��Ȃ����������܂���ˁB���ʕs�ǂ������o���͂��܂肠��܂��A���������ɂȂ�����A�ߕ��ʂŐF���������������͑��X����܂��B�F�������Ȃ��ƌ����ƕ��ʂ��s�ǂ��Ƃ��������Ǝv���܂��B���ʉt�̃A�j�����N�����z������3�ʎg���������ǂ��ł��傤�B�g�p����A�j�����̗ǂ��������W����悤�ł����A�h�i���F�ɂȂ����j�Â��A�j�����h���ǂ��Ƃ����b������܂��ˁB���ƃo�b�N�͊��S�ɐ^�����ɂ͂Ȃ�Ȃ��i�����܂ŗ��Ƃ��Ɛ��ۂ��E�F���Ă��܂��j�̂ŁA���̏�Ԃ�F�������Ȃ��Ɗ����Ă���Ƃ����������邩�ȁH�B���ȕԓ��Ő\����܂���B
�ԐM�@�z���c�A�[�͂ނ��������ł����?_+�j���������ς����ă����������Ă��܂��܂��B�����I�I���݂܂����ɂȂ��Ă��܂��܂��B
�ԐM�@�������̂Ƃ���Ŏg���Ă��Ȃ��̂ő��̎{�݂̂��̂��Љ�����Ǝv���܂��B���m���Z�t��̕a�������ǂ̍H�v�R�[�i�[�Ƀ}�[�L���O�̎����o�Ă��܂����BDavidson Marking System�Ƃ����āA�h�̐����������ȁB�ڂ�����
http://www.aichi-amt.or.jp/labo/patho/device.htm �����ĂˁB���m���Z�t��̕a�������ǂ̃y�[�W�͂Ȃ��Ȃ��[�����Ă���̂Ő���݂Ȃ������x���Ă����ĉ������B�i���m�̔Lj��ł��F�B�������̂ł��܂��܂̂����ɍs���Č������B�j
�ԐM�@�����ł͒f�[�ɂ͖n��p���Ă��܂��B�����n�`���Ԃ��n�i�����̎��ԂŐ搶�������Ă���j�Ƃ��ɗ����邱�ƂȂ�������ł��B
�ԐM�@�����F����̃��[����ǂ�Ŋ��S���Ă��܂��B�h������܂��ˁI�I�f�[�̈�ɂ͓��@����n���n���g�p���Ă��܂��B�����Ă͂��Ȃ��ł������n���痿�n�C���N�Ȃ�L�@�n�}�ɋ����Ǝv���܂��B
�ԐM�@���@�ł���x�n�`�ł��߂����̂ł����A�����������̂Ǝ��b�ɂ͂������悤�Ȋ����������߂��悤�ɋL�����Ă��܂��B���̂̂��A�p�C���b�g�Ђ̃C���N���g���A�����h�肻�̂��ƃu�A���Œ�t�ɏ����Z���ĐF�f���d����������@���s���Ă܂��B�č��ł̕��@�𗬗p���܂����B�����炭�A�n�`�ōŏ��Ɍ��������Ƃ��́A�n�`���̂ɖ�肪�������̂�������܂���B�Ȃɂ��A�ُ�ɌÂ����̂��g�p�����̂ŁE�E�E�B���x�͐V�������̂��g�p���Č������Ă݂܂��B����Davidson Marking System���č������ł��ˁE�E�E�B
�ԐM�@���\�N���炢�O�h���Z�i�~����ƃ��`�J���~���̏d���F�ɂ��N���v�g�R�b�J�X�̋ەǁA䰖��̓������F�@�h�Ƃ������e�Ŋw��\�������ہA�O���R�b�g�͂��Ȃ蒲�ׂ��o��������܂��B�i�Ƃ������Ƃ͂��̘_�������������ŐQ�����Ă���10�N�Ƃ����ɂȂ�܂��ˁB�j�^�ۂ̑����ނ��_�����ăA���f�q�h��������Ƃ������Ƃɂ����Ă͓������Ǝv���܂��B�_��������Ȃ���A�P���@�ۂȂǑ��̐��������܂��Ă��邵�A�ߎ_�����Ƌ����͂Ȃ��Ȃ�܂����^�ۂ̐��F���������܂��B�}�b�\���ȂǂŎg�p���邱�Ƃ�����d�N�����_�̕����_���͂��キ�^�ۗނ݂̂���ߏo���̂ɂ��Ȃ莞�Ԃ��������Ă��܂��Ɛ��肳��܂��B�i���邢�͎シ���Ċ��S�Ɏ_��������Ȃ���������Ȃ��j�����N�����_�ȊO�͎g�������Ƃ��Ȃ����A���̂悤�ȋL�ڂ������܂���B�u�d�N�����_+���_�v�͉����ʂ̐��F�̎_���@���������Ă���̂͂Ȃ��ł��傤���B
�ԐM�@������Ăǂ�����^�ۂ���߂邽�߂̂��̂ł���ˁB�d�N�����_+���_�̕��@�͂�����ƒ��ׂ�����ł͌�������܂���ł����B�{��ɓ���܂��B�܂��A���w�����݂Ă݂܂��傤�B�����N�����_ CrO3 (�_���N����(IV))�A�d�N�����_ K2Cr2O7 (��N�����_�J���E��)�Ƃ��Ɏ_�f����o����̂ɓs���̗ǂ��\���ƂȂ��Ă��܂��ˁB�_���ȊO�̖ړI�͍l���Â炢�ł��ˁB�\�����͌��ݎ茳�ɂȂ��̂ŁA�ǂ��Ă��m�点���܂��B���ɃO���R�b�g���F�ɂ����Ă����̕������g���Ď_�����錴���I�v�f���l���Ă݂܂��B�`�����ⓜ���Ȃǂ��\�����鐬���ɂ�-OH����܂ނ��̂��������݂��܂��B���F�Z�p�Ŏ_���Ƃ́A���̂悤�Ȋ��\���ω��������p������܂��B�܂�A���܂��܂�-OH��̎_���������_��������Ζ��Ȃ��킯�ł��B���w�����n�ł́A-OH��̎_�������͗L���ŁA�����炭��w���x���̗L�@���w�̋��ȏ��ɂ͂قƂ�Ǐo�Ă��锽���ł��B�ȉ��A�����ȏ����Ȃ��̂ŁA����o���̒m���Ő\����܂��A�Ή������Ă��������܂��B������܂��ƁA�ꋉ����ѓ̒Y�f�ɂ�OH��͎_���\�ł��B�O���ł͈��萫�����債OH��(���q�͑��u���ł������قLj���̕����ɌX��)�̎_���͂�����܂���B���Ɏ_�������̋����ɂ���āA�����������ɍ��ق�������Ƃ����_�ł��B�����A�_���\��-OH��ɑ��Ďア�_�����s����-CHO��(�A���f�q�h��)�ɕω����܂�(�ڍׂ͌�قǁE�E)�B�����āA���������Ɏ_��������A-OH��������_�Ŏ_�������ꍇ�ɂ�-COOH��ւƕω����܂��B
=C-
|
-C=O
-C=O
-C=C-OH >> |
>> |
|
H OH
�ŏI�I�Ȏ_�����������ł���-COOH�͈��萫������(�t�ɂ����Δ������ɖR����)-COOH���Ҍ�����-CHO�Ƃ���Ҍ������́A���̌��̂ł͂��Ȃ��������ɗǂ������n�͌������Ă��܂���B�܂�A��{�I�ɂ͉E�����݂̂̔����n�ƂȂ�킯�ł��BPAS���F�Ȃǂł́A�ア�_(�߃��E�f�_)����������-OH���-CHO��ɕς��A�V�b�t�Ƃ̔��F������Ƃ������������ƂȂ��Ă��܂��B���A�l�I�ɂ́A�V�b�t��OH�Ƃ��������Ă���Ǝv���Ă��܂��B�O���R�b�g���F�����l�ŁA�g�p����郁�Z�i�~�����-OH��܂���-CHO��Ƃ̋z�������悭�A�Ⴆ�Ύア�_�Ŏ_�����s�����ꍇ�ɂ́APAS�Ɠ��l�̐��F�ԓx�������Ă��܂��܂��B�O���R�b�g���F�͐��F�Ώۂ�����ꂽ���F�ł���APAS�̂悤�ɗl�X�Ȃ��̂����܂��Ă͍���킯�ł��B�����ŁA�����_��-OH����_����-COOH��ɂ��邱�Ƃ�-OH����Ԃ���-CHO����-OH��R���̔�����}�����Ă���킯�ł��B���ۂ�PAS���̐��F�ŋ����z�������������Ȃǂ�-OH�����ɑ����܂�ł��܂��B�^�ۂ���߂����ꍇ�A�ۑ̖̂��\���������܂�Ηǂ��킯�œ����Ƃ̔����͕K�v����܂���B�����ŁA�����_��p����-OH����Ԃ��Ă���킯�ł��B�O���R�b�g���F�Ɠ��l�ɃO���h���[���F�Ƃ������̂�����܂����AOH��̗}�������͂���Ɠ��l�Ȃ̂ł��B�ŁA���_�͂Ƃ����ƁE�E�E�B�ǂ����OH��̎_����p����ړI�ō��ق͂Ȃ��B�����ċ�����A�_�����Ԃ̈Ⴂ���x�ł͂Ȃ����ƍl�����܂��B�ł͂�(^^)�ǐL�@�ƂɋA������A�������ȏ����݂Ă݂܂���(^_-)
�ԐM�@�O���R�b�g���F�̎_���܂ŁA�u�����N�����_�v�A�u�d�N�����_+���_�v�ł����A�����́A�o�s�`�g���F�̃N���������Ƃ��Ďg�p����܂��B�����炭���K���́A�o�s�`�g���F�̃N���������ƍ������Ă���̂ł��傤.���]�k������������ɂ�������A�o�s�`�g���F�����肵�Ȃ��Ĉꎞ���ł����A�a����ɂ��̐��F�̃I�[�_�[���~�߂Ă���������Ƃ�����܂��B�P�N�ȏ�A����₱��⌟�����A�ŏ��͂o�s�`�g���F�t�ɖ�肪����Ǝv���Ă����Ȓ����Ō���������ł������܂����������N����ق��Ƃ�����ł����A������ӂƁA�o�s�`�g�̉t�͉������Ȃ��ŐؕЂ���ꂽ��ǂ��Ȃ�̂��Ǝv���A�������߂Ă݂�ƁA�ӊO��S�̓I�ɐ��܂��Ă����̂ł�.�܂�A�����̐��F�@�����ꂽ���̌Œ�t�́A�c�F���J�[���̃N�������������Œ�t���嗬���Ƃ������ƂɋC�����u�����N�����_�v�A�u�d�N�����_+���_�v���g���Ă݂��̂ł�.���҂Ƃ��A��ɏ����i�d�����͒`���Ɍ������₷������������j���A�o�s�`�g���F�t�ɓ����ƁA����ɐ��F������������Ă���A�������́A�߃}���K���_�J���ɂ��_���ŁA����̉���A�_�o�P���ۂ��c����i���ʁH�j�邱�Ƃ��������̂ł��B���Ȃ݂ɁA����ɂ́A�u�����N�����_�v�A�_�o�P���ۂɂ́u�d�N�����_+���_�v�������g�p���Ă��܂�.
�ԐM�@ �ڂ����\���グ��ƁA�ꋉ��OH������Y�����f�̎_��������
H
| [O] R-C=O [O]
-C=O
R-C-OH ---> |
----> |
|
H
OH
�ŃA���f�q�h���уJ���{�L�V����ɕω����܂��B���̕ω��͊�{�I�ɂ͑O���点�����Ƃ���ł��B���ɂQ����OH������Y�����f�̎_��������
H
| [O] R-C=O
R-C-OH ---> |
| �@ R
R
�ƂȂ�P�g���ƂȂ�܂��B���������̔����͉ƂɋA��Ȃ��Ǝ���������܂��A�ǂ��炩��R-C�̌������ؒf���ꂽ�ꍇ�ɂ͈ꋉ�̒Y�����f�̔����̂悤�ɃA���f�q�h�ɂȂ�\��������܂��B�������A�����̋������炢����R-C�̋��L����(�Ќ���)����C=O�ɂ�����Q�d����(�Ќ���+�Ό���)�Ƃ��ɃΌ����̕������Ƃ�₷���Ȃ邽�߂�
R-C-X
|
R
���܂��l�����܂��B�A���f�q�h�ɕω�����ɂ�-C-C-��������Ȃ���Α��݂����Ȃ��̂�C-O-�A-C=O�����C-C�̌����𗣃G�l���M�[�ׂ�K�v������܂��B(���ȔN�\�ł���ׂĂ݂܂�(._.))�܂��A�����̈�A�̔�����E2�E�������ł����Ȃ��Ă��锽���@�\�ł��B���̎����ł̎_���������A�����̔������N�����ɃV�b�t���̔������N�����Ă���ƍl���ėǂ��Ǝv���Ă��܂��B�܂��R����OH������Y�����f�̎_�������͗��̍\�������ݍ����Ă邽�ߔ������}�X�N����Ă��܂��A�E���������炸�ω��������܂���B
�ԐM�@���N���v�g�R�b�J�X�̌��o�ɂ͍זE������߂�O���R�b�g�@�ƁA䰖�����F���郀�`�J���~�����F������܂����A�����̏d���F�̓O���R�b�g�@�̃N�����_�ɂ��_��������䰖��̐��F���������Ă��܂����߂ɍ���ł����B�����ʼn߃��[�\�_�ɂ��キ�_���������{������iPAM�ȂǂɎg�p����Ă���j�`�I�Z�~�J���o�W�h���g���A������������������Ń��Z�i�~�����t���܂��B���̔����n���͓̂d���Ŏg�p����Ă�����̂ł��B���̌ダ�`�J���~����䰖�����F���A�J�E���^�[�X�e�C���Ƃ��ă��^�[�j�[���C�G���[���{�����ƂŁA�������A䰖����ԁA�o�b�N�����F�ƃR���g���X�g���ǂ��W�{���ł��܂��B���̐��F�̔w�i�ɂ͓���AIDS�Ȃǂ̓��a�����������ɂȂ����ۂ�AIDS���҂ɂ͔�䰖����N���v�g�R�b�J�X�������Ƃ��������������̂ł�����A�������܂�Ɩʔ����̂ł͂Ǝv�����̂��n�܂�ł��B�P���ɃO���R�b�g�ƃ��`�J���~���̗������F����ς�ł��܂��b�ł͂���̂ł����B�֑��ł����A���̍���C�̎���ł₽�瑽�d���F�ɋÂ��Ă��܂����B�X�������O�d���F�i��������Ă��鏊�͂Ȃ��ł��傤�ˁB�j�A���f�n�C�g�t�N�V�����}�b�\���i�����I�ɂ͂��`�����ǂ��Ǝv���Ă���j�r�N�g���A�u���[���}�b�\���S�[���h�i�[�r�N�g���A�u���[���R���S�[���b�h�i���ǕǂȂǂ��A�~���C�h�Œu��������Ă���l�q���ǂ�������B�����߁j�r�N�g���A�u���[���O���R�b�g�i���Ǖǂ��ۂ��˂��j���Ă���̂��ǂ�������j�ȂǂȂǁB�F�L�`�K�C�A�h��D���Ƃ����l���ɑς��Ȃ���˂��i��ł����������������B
�ԐM�@�z������ƁA�ƂĂ����ꂢ�Ȑ��F�̂悤�Ɏv���܂��B�N���v�g�R�b�J�X���āA���F�@�������ł��ˁB�A���f�n�C�g�t�N�V�����}�b�\�����āA�ʐ^�ł����������Ƃ��Ȃ��̂ł����A���������ꂢ�Ȑ��F�ł���ˁB�i����̐��F�̈�ł��B�j�r�N�g���A�̏d���F���āA�C���C������̂ł��ˁI�т�����ł��BVB-�R���S�[�Ԃ�VB-�O���R�b�g�͂���Ă݂����ł��I����ς�A���F�́u���ꂢ�ŕ�����₷���v����Ԃ��Ǝv���܂��I
�ԐM�@�P�g���Ɋւ��ẮA����ȏ�_�����Ă��傫�ȕω��݂͂��܂���B�ނ���ʔ����̂̓P�g����A���f�q�h�̐��n�t���ł̐U�镑���ł��B�P�g����A���f�q�h�͗n�t���ł͐��̋��j�I��p���ăW�I�[�����`�����܂��B
�W�I�[���̉��w�\����
R
|
R-C-OH
|
OH
OH��������ol(methanol,ethanol)�ƂȂ�A����炪�����̂łQ(di)-ol�ƂȂ�܂��B�P�g����
�@�@�@R-C=O
|
R
�ŁA H:OH
�@�@�@R-C=O ---------> OH
|
|
R
R-C-OH
|
R
���`�����܂��B����AOH����_�����ăP�g����b�����܂������A�P�g���͂Ő��n�t���ł�H:OH�̋��j�I�U�����ăW�I�[�����`������Ă���̂ł��B�������A���̔����̓P�g���ł��邩�A�W�I�[���ɕω����邩��R�̍\���Ɉˑ����܂��B�������Ȃ���AR���ǂ��ł���P�g���ł���W�I�[���ł��邩�͈�T�ɂ͌����܂���B���R�E�̖@���ǂ���A������Ȍ`�Ԃ��Ƃ�̂��Z�I���[�ł��B�ȏ���A�Ⴆ��PAS���F�ŃA���f�q�h����߂�Ƃ�������͎��ۂɂ͂ǂ��Ȃ̂����^�≻����܂��B�ȒP�Ȏ��������Ă݂܂��B�z�����A���f�q�h�̐��n�t�ɃV�b�t����𐔏\�ʂ���Ă݂܂��B�����ȐԎ��F��悷���ŁA�Ȃ�قǗ��_�ǂ����������ł��傤�B�������Ȃ���A�悭���ׂĂ݂�ƃz�����A���f�q�h�͐��n�t���ł͂���95%�ȏオ�W�I�[���ő��݂��Ă���킯�ł��B���Ȃǂ́A�����Ђ˂���Ă���̂ŁA�V�b�t�t���ăA���f�q�h�ł͂Ȃ��ăW�I�[�������o���Ă���̂ł͂Ȃ����ƍl���Ă��܂��܂��B���Ȃ݂ɁA�P�g����L����A�Z�g���n�t�ɃV�b�t�𐔏\�ʓ���Ă݂�ƁA�W���A�W�����F�����\����ɏo�����Ă��܂��B�����A�P�g���ƃV�b�t�͔������ɖR�����̂��Ɗ����܂����A��͂�悭����ׂĂ݂�ƃA�Z�g���̓W�I�[���̌`����1%�ɖ����Ȃ����̂Ȃ̂������ł��B������Ƃ����āA���̗��_����V�b�t�ƃW�I�[����Z���I�Ɍ��ѕt������قǁA�P���Ȃ��̂ł͂���܂���B������������邽�߂ɂ̓V�b�t�̍\�����l���Ȃ���Ȃ�Ȃ��悤�ł��B�ߓ����ɂÂ����E�E(�Â�)
�ԐM�@�ȉ����Ȃ���I�ɂȂ�̂ŋ����̂�����݂̂����������� @@@@@@
�O��Ɉ����������F���_���E�E�E�B�V�b�t�t�̉��w�@�\���l���Ă݂܂��B�V�b�t�̎�v���F��̓p�����[�Y�A�j�������͂��߂Ƃ��鉖��t�N�V������̂ƂȂ�܂��B����t�N�V����Triaminotriphenylmethanes(Rosanilins)�ɑ���BASIC FUCHSINS (CI),
PARAROSANILIN (MAGENTA O) [C.I. Basic Red 9] C.I. 42500, ROSANILIN (MAGENTA
I)(CI) [C.I. Basic Violet 14] C.I. 42510, MAGENTA II, NEW FUCHSIN (MAGENTA
III)(TRAD)[C.I. Basic Violet 2] C.I. 42520�Ȃǂ����݂��܂��B��{�ƂȂ镪�q���i�͂R�̃x���[���ƒ��S�ɑ��݂���Y�f(C)���O�p�`��Ɍ����������̂ŁA�����͑ΏƐ����ǂ����ʍ\����悵�Ă��܂��B�x���[���͋����_�ɂ��Y�f�E�Y�f�̌����͂��悻�P�D�T�d�����ł��邱�Ƃ��������Ă��܂��B�܂��A���S�ɑ��݂���Y�f�͂�͂苤�\����悷����̂̃x���[���قǂ̈��萫�͓����܂���B�\�����炱�̌����͂��悻�P�D�R�d�����ł���Ɛ��@����܂��B�������A�����͋��\���̂�悷�邽�߂ɐF�f�Ƃ��Ă͓d�q���L�������蓙���̌�����悵�A���̈��萫�����ɋ������̂ƂȂ��Ă��܂��B���̈���\����悷��F�f���A���_�ŏ������邱�Ƃɂ��d�q�̉𗣂��͂��܂�܂��B���_�����ł͐F�f���q�ɕs���艻��������A���L������Ă����]��d�q���{���̓d�q�z�u�ɖ߂蒆�S�Y�f�̖������d�q���ߏ�ɂȂ�܂��B����āA���̉ߏ�ɂȂ����d�q�́A�u���u�����Ă���킯�ɂ������Ȃ��̂Ńp�[�g�i�[��T���o���܂��B�V�b�t�t�ɂ͈����_�i�g���E�����܂܂�Ă��肱��-SO3�ƒ��S�Y�f�̉ߏ�d�q������������ƂȂ�܂��B���̍\�����w�I�ɂ́A���ʍ\����悵�Ă�������t�N�V�����q���c�ȎO�p���`��悷�邱�Ƃ��\�z����܂��B����t�N�V���̔��F��c�͎O�̃x���[���Ƃ��̒��S�Y�f����\������Ă��܂��B�����́A���\������Ȃ�A���G�l���M�[�̋z���g��(�ԐF��)�Ƌ��U�����邱�ƂŔ��F��������킯�ł����A���̍\�����ω�����Ɠ����ɋz���g�����ω����Ԏ��F��悵������t�N�V���������W�����F��悷�铧���ȉt�̂ɕω�������̂ƍl�����܂��B���ۂ̐��F�̃��J�j�Y���́A�_���ɂ�萶�����A���f�q�h��-SO3�����Č������ApH�̕ω��ɂ����-SO3��������Ԃň���ł����������t�̂����̉���t�N�V���̏�ԂɋA�邱�Ƃɂ���Ĕ��F����Ƃ����A���ɉ��w�I�Ȑ��F�Ȃ̂ł��B���̂��Ƃ́APAS���F�ŃV�b�t�t>�d�����_�����s������̗���������s���ƐԐF�̔��F�̃R���g���X�g���ǂ��Ȃ�Ƃ����o���I�����ƍ��v���܂��B�ȉ��ߓ����ɂÂ�(^_-)
�ԐM�@����̃V�b�t�ɂ��Ăł����E�E�E�B�u���_�����ł͐F�f���q�ɕs���艻��������A���L������Ă����]��d�q���{���̓d�q�z�u�ɖ߂蒆�S�Y�f�̖������d�q���ߏ�ɂȂ�܂��B����āA���̉ߏ�ɂȂ����d�q�́A�u���u�����Ă���킯�ɂ������Ȃ��̂Ńp�[�g�i�[��T���o���܂��B�V�b�t�t�ɂ͈����_�i�g���E�����܂܂�Ă��肱��-SO3�ƒ��S�Y�f�̉ߏ�d�q������������ƂȂ�܂��B�v���̌��ɂ��Ēlj����؎������s���Ă݂܂����B�O��L�ڂ������e�ɊԈႢ������܂����̂Œ��������Ă��������܂��B����t�N�V���́A-SO2�܂���-SO3�Ƃ̔��������F�߂��A�_�����łȂ��Ă����������F��ω����܂��B����́A���S�Y�f��-SO2�܂���-SO3�Ƃ̐e�a�����悭�A������Ȃق��֔�������Ƃ��������ɏ]���܂��B
�ԐM�@�ȉ����Ȃ���I�ɂȂ�̂ŋ����̂�����݂̂����������� @@@@@@
�O��Ɉ��������A�V�b�t����ɂ��čl���Ă݂܂��B�V�b�t����̊T�v�͑O�m�点�����ʂ�ł����A�����Ă������̂������̂ł�������l���Ă݂܂��B����́A�V�b�t�ɂ����鉖�_�̑��݂ł��B���̌��\�ɂ��Ă͂��낢��Ƃ���Ǝv���܂����A���낢�뒲�ׂĂ݂�Ɩʔ������Ƃ�������܂��B�V�b�t����̃A���f�q�h�Ƃ̔����͌Â����瑶�݂��A�Ƃ��Ƀz�����A���f�q�h�̌��o�ɊW�����肻���ł��B���̒��ׂ��z�����A���f�q�h���o�@(Denige's Method)�ɃV�b�t����̋L�ڂ�����܂����B����n�t�Ƀz�����A���f�q�h�A�A�Z�g�A���f�q�h�Ȃǂ����݂���Ƃ��ɁApH��0.7���x�ɂ���ƃz�����A���f�q�h�݂̂����o�ł��܂��BpH0.7�̃V�b�t����ł́A�A�Z�g���A�t���t���[���A�V���E�m�E�A�u�h�E���A�V�����A�T���`���_�A�N�G���_�A�a�_����уn�b�J���Ȃǂ�2%�n�t�ɑ��ĕ��̌��ʂ������Ƃ���Ă��܂��B���́A�V�b�t���Ȃ��g�D���w�Ɏg��ꂽ���̌o�܂͒m��܂��A���̂悤�Ȍ��o����Ƃ��ẴV�b�t���g��ꂽ���߂ɉ��_������Ƃ������c���c�����̂�������܂���B���ۂ̃V�b�t�����pH���ǂ̂��炢����̂��͎��͒m��܂��A�_���ɂ��邱�ƂŃA���f�q�h�A�P�g���A���_��Ƃ̔����ɓ��ِ�������A����Ɏ_���ɂ���ƃz�����A���f�q�h�̂悤�ȒP���ȃA���f�q�h�ɂ̂ݔ�������Ƃ����������킩��܂����B�����ł́A�V�b�t��������Ɛ��Œ�������{�݂͔��ɏ��Ȃ��Ȃ��Ă��܂����B�������̂悤�Ȑ��i�̎g�p�҂͂��̂悤�Ȃ��Ƃ�Y�ꂪ���ł����A�����ɂ��l�X�ȉ��w�I�v�f�����݂��A������ʂȂ��̂������Ă��Ȃ��������炩���܂��ˁB
�ԐM�@���L�ɏڂ����L�ڂ�����܂��B>http://members.pgonline.com/~bryand/StainsFile/stain/micro/heliaytb.htm�Ɖu���F������̂ɂ�����Alcian
Yellow and Toluidine Blue (AYTB)���F������̂͂Ȃ��ł��傤���H
�ԐM�@�������m��Ȃ������̂�medline�Œ��ׂ�Ƃ������o�Ă��܂��ˁBMod
Pathol 1998 Jan;11(1):72-8,A novel Alcian yellow-toluidine blue (Leung) stain
for Helicobacter species: comparison with standard stains, a cost-effectiveness
analysis, and supplemental utilities.���܂胁�W���[�ł͂Ȃ����F�@�̂悤�ł��ˁBAlcian Yellow�ŔS�t�����F�ɐ��߂�toluidine
blue�Ő����܂���HP���R���g���X�g�悭������炵���B�}���ق֍s���Ē��ׂ�ׂ��B
�ԐM�@HP���F�̘b�ɂȂ��Ă��܂����ˁ[�A���݁C���{�݂ł́CHP�̓�����F�ƂȂ�ƍy�f�R�̖@���s���Ă��܂����CAlcian
Yellow and Toluidine Blue(AYTB)���Ă������F�@�������ł����[�H�m��܂���ł����D�@����ɁC���̐��F�͒ʏ�̌��w�n�p(������p�j�̂��̂̂悤�ł��ˁ[�D�R���g���X�g���ǂ����F�Ȃ琥���Ă݂����Ǝv���܂��D�ȑO�C��������t����̈˗���HP���F�ɂ��Ă�����Ƃ������������Ă݂����Ƃ������ł����ǁC�A�N���W���I�����W�������x�E���R���g���X�g�ŁC�ċC�e�X�g�Ƃ̑��ւ��ǂ��C�Ȃ��Ȃ�������[�Ȃ����ȁI�H�Ǝv�����L��������̂ł����c
������̎��Ƃ͒��ڊ֘A�͂Ȃ��̂ł����A�y�f�����ł����^��i�s���j�Ɋ����Ă��鎖������܂��B����͍y�f�̗͉������Ă��鎖�ł��B�����y�f�i�Ⴆ�y�v�V���Ȃǁj��0.1%�Ƃ����Ă��A�͉����قȂ�Ό��ʂ͂��Ȃ�Ⴄ�Ǝv���̂ł����B�����͖ܘ_�̂��ƁA�_���i���ɓ��{�́j�ł������L�ڂ̕����ƂĂ������B����ŔZ�x�⎞�Ԃ�_����Ȃ�ăi���Z���X�Ƃ����v���Ȃ��B
�ԐM�@�y�f�����ł�����������̌�����悤�ɍy�f�����̒Ⴂ���̂����ׂ������Ƃ�����܂����B
�ԐM�@����́A�ǂ̂悤�ɕ\�L����Ηǂ��̂ł��傤���B�܂��A�͉��̑���͂ǂ̂悤�ɍs���Ηǂ��̂ł��傤���B
�ԐM�@���͉��Ƃ����\�����������Ȃ�������������܂���ˁA���j�b�g�ł��ˁB(�莝����pepsin�̓J�^���O�� 800-2500 units�ƂȂ��Ă���1310 units/mg prot.�@�������B)�@��f�[�^�[�V�[�g�ɋL�ڂ�����̂ł��炽�߂đ��肷��K�v�͂Ȃ��ł��傤�B
�ԐM�@���@�̃g���v�V���ɂ͕\��������܂���ł����B������āA��?(@_@)
����Ǎw������Ƃ��́A������Ƃ����\���̂�����̂ɂ��܂��B
���V�A���̓A���J�����ŕۑ����邱�ƁB�悢�q�͎_�Ȃǂ������Ȃ��łˁB���{�݂ɂ���Ĕp�t�Ɋւ��Ă̓��[���݂����Ȃ��̂�����̂ł͂Ȃ����Ǝv���܂����A�����ł͗L�@�n�}�͉R���i�L�V�����A�A�Z�g���Ȃǁj���f�A�n���Q���n�i�N�����z�����j�ɕ����ďW�߂ĉ�����Ƃ̓V�A���A�q�f�A����A����ȊO�̏d�����A�N�����A�z���}�����A�t�F�m�[���A�_�A�A���J�����i��w�j���ʂ̕��ނŁB�a���Ǝ��Ƃ���DAB�A�d�N�����_�A�|�_�E�����A�u�A���A�G�|���ȂǂȂǕ�������͈͂ōׂ����S�ĒP�̉���ł��ˁB��{�I�ɑS�ĉ���A�Ǝ҂Ɏ����Ă����Ă�����Ă܂��B�i��w�Łj�ǂꂾ���������������Ă��邩�͕s���ł����A���������ȋ��z���Ǝv���܂��B�|���e�킪�召20���炢���낪���Ă��āA�����̉��͔p�t�e�킾�炯�ł��B�����Ƃ��āA���������ɗ����Ă͂����Ȃ��Ƃ������ƂɂȂ��Ă܂��B�������A���R�[���Ȃǂ͂����Ă��܂��Ă��܂��ˁB�w�}�g�L�V������G�I�W���Ȃǂ́i�d�����ȂNJ܂�ł��Ȃ��j�F�f�͂������Ɨ����Ă��܂��Ă܂��ˁB�A���J���͉���Ƃ����Ă����w����Ȃǂ͋��A���J���ł����A�����Ă��܂��Ă܂�����A����Ƃ�������ł��ˁB���������a���ł͎���͍������Ďg�p���邱�Ƃ������A���ނ���͓̂���ł��ˁB
����@�g�o�Ȃ���Ńw���R�o�N�^�[�̖Ɖu���F�ɂ��Ď��₳���ĉ������B�v���e�C�i�[�[�i�����j10��, 3���ߎ_�����f���^�m�[�� 10��, HP�R��(����)�@�@�@�@�@�@�@�@
�@60���i37���j,������������SAB-PO(MULTI),���g�p���Đ��F���Ă��܂��B���F���ʂ͗ǍD�ł��B�Ƃ��낪�������������l�`�w-PO(MULTI)���g�p����Ɛ��F�������Ȃ藎���܂��B���̎{�݂ł͂������ł��傤��
�ԐM�@����r�������Ƃ��Ȃ��̂ŕ�����܂��A�j���R���ȂǂŃ|���}�[�@�ł͊��x���ቺ���邱�Ƃ��m���Ă��܂��B�j���Ɠ��l�ɋۑ̖̂��ʂ��R�̂��ʂ蔲���ɂ����ƍl����ƁA���F�����ቺ���鎖�ƈ�v���邩�Ǝv���܂��BSAB�@�Ŏ�ɐ��F���Ă��܂����A�ł�����|���}�[�@�ɐ�ւ������̂ł����A�����p�̕ςȁi�H�j�R�̂�j���R������F���邱�Ƃ������̂ŁA�Ǘ�ɂ���Đ��܂�Ȃ�������Ǝv���ƂȂ��Ȃ����ݐ�܂���B�m���ɐ��܂镨�Ɋւ��Ă̓|���}�[�@���g���Ă܂��B�����̍R�̂ł͍y�f�������O�����Ƃ��Ďw�肵�Ă���܂��ˁB���Ђł͔M�����Ȃǂ𐄏����Ă���Ƃ��������܂��B
�ԐM�@���@�ł�SAB�@�ƃ|���}�[�@���g�������Ă��܂��B�t�����̖Ɖu�O���u�����͓������r�I�`���̉e�����Ȃ��|���}�[�@���g�p���Ă��܂��B����IgA�����ɂ��ꂢ�ɐ��F����܂��B
�ԐM�@�^���p�N�����ƃ|���}�[�@�̌��ł����A���@�ł̓^���p�N�����̓g���v�V���ƃv���e�A�[�[���g�p���Ă���܂��B�g���v�V���͂���Ȃɋ����Ȃ��������A���b�g���͂��܂�Ȃ��̂ŁA�قƂ�Ǔ����Z�x�Ŏg�p���Ă���܂��B�v���e�A�[�[�Ɋւ��Ă͈ȑO�т����肵�����炢�ɁA�זE���Ƃ낯�Ă��܂����̂ŁA����ȗ��V�����r�����g�p����ۂɂ͔Z�x���`�F�b�N���Ă���g�p���Ă���܂��B���̂Ƃ���Ђǂ������o�Ă��銴���͂���܂���B���ƁASA����M��X�ł����A���܂肻�̂悤�Ȍo�����Ȃ��̂ʼn��Ƃ������܂��A�Ƃ��ǂ��A�ꎟ�R�̂Ƃ̑�������邭���܂��Ă��Ȃ����Ƃ�����܂����ASA����M��X�͓�����ЂȂ̂�SA����M��X�ō����o��ƌ������Ƃ͂�����Ɠ���ł��ˁB���@�ł��ȑO��SA�����g���Ă��܂������AM��X�ɐ�ւ��Ă��܂��܂����B�j���R���͂������A�^���p�N�����������Ȃ����Ƃ��Ȃǃ|���}�[�@�ł̓o�b�N���o�Ă��܂������̂��AM��X�ł͂��ꂢ�ɐ��F����܂��B�������A�|���}�[�@���悢�R�̂�����܂��B������ƕ��G�ɂȂ��Ă��܂��܂����ꎟ�R�̂ɂ���ĕς��Ă��܂��B
�ԐM�@�����v���̂ł����R�̂ō����łĂ��܂��܂��B��������̂Ƃ���̃w���R�o�N�^�[�̐��F�@�������Ē����܂������肢���܂��B�������A�|���}�[�@���悢�R�̂�����܂��B
�ԐM�@���{�݂ł́C������������SAB��Envis�����Ƃ��āC���C������������MAX�ɐ�ւ��悤���Ƃ������x���Ԃ̎����ł��D�Ƃ���R���iE-cadherin�Ȃǁj�ŁC��r���Ă݂�ƁC���x�́CEnvis������������������SAB��������������MAX�ŁC�܂��R���g���X�g���̐��F����������������MAX���ł��悩�����Ǝv���܂��D��T�ɂ͌����Ȃ��Ǝv���܂����C�l�����o����R����R�̂̎�ޓ��i�Ǎ݁E���q�ʁE���x�E�R�������c�j�C�l�X�ȗv���ɂ��C�œK�Ȍ��o�L�b�g�͈قȂ�Ǝv���Ă��܂��D�����悤�Ș_�����C�g�a���ƗՏ��h���͂��߂Ƃ��đ������������܂��D�����C���[�`���ł��ƂȂ�ƁC�R���E�R�̂͂��܂�����Ȃǂ����detection
kit��ς���͔̂ώG�Ȃ̂ŁC�����͖ڂ��ނ��āC���F�ȂǂŒ�������悤�ɂ��Ă��܂��D���Ȃ݂ɁC���{�݂ł́C���M�����ɂ��R�����������s���悤�ɂȂ��Ă���́C����ٔ������o�₷���Ȃ�Ȃǂ̗��R�ɂ��C������Multi�^�C�v�͗p���Ă��܂���D
�ǐL�D���_�C���o����R����p����ꎟ�R�̂ɂ���āC�R���������@�i�������C�v���e�A�[�[�Ȃǂ̃^���p�N�����y�f�����C���M�����ɗp����o�b�t�@�[�̎�ނ����pH�E���x�E���ԂȂǂ̏������C�E�ʊ����ܓY���̗L���C�E�ʊ��������C�_�E�A���J���������X�j�́C�ς��Ă��܂��D�ǐL���̂Q�������@�́E�t�Ȃǂ̓������r�I�`����������������ł́C�r�I�`���̃}�X�L���O�͂��܂肤�܂������Ȃ��̂ŁCavidin-biotin�n��detection�͗p���Ă��܂���D�i�֊����Ǝv���Ă��܂��D�������������͑ϔM���ł����c�j�܂��C�������y���I�L�V�_�[�[�����̍��������n�i�����E�������j�ł́Calkaliphosphatase
labeling��p����悤�ɂ��Ă��܂��DCSA or TSA�́C����ۂǂ̂��Ƃ��Ȃ�����͗p�����C�ꎟ�R�̂̎�ނ�Z�x��ς���Ȃǂɂ���đΉ����Ă��܂��D�܂��C�V���v���ȊԐږ@���p���Ă��܂��D�܂��C���F���ア�Ƒz���������̂Ɋւ��ẮC�C�~�_�]�[���Y��DAB��p���C���F������ɁC����ς�ア�悤��������C�I�X�~�E���_���������Ă��܂��D�i���_���������́C���I�ɔ��F���Z���Ȃ�Ƃ͎v���Ă��܂���j�c�c�B�ϕ��EMW�E�I�[�g�N���[�u�����Ȃǂ�����ƁC�ǂ����Ă�������Ă��܂����ǁC���M�n�̍R�����������K�v�Ȃ��̂́C�E�p����C�ؕЂ�K�ȉ��M�����p�n�t�ɐZ�Ђ��C60����2�`3����������Ƃ��Ȃ�R���������܂��D�܂��C���M�n�̍R���������K�v�Ȃ��R���E�R�̂ł��C�זE�f�ޗ��Ȃǂɂ����ẮC�o�b�N�O�����h�������R���g���X�g���グ����ʁi���Ɋj�R���Ȃǁj������܂��D�i���M�������֊��̂��̂͏����j
�F����C���������Ƃ͎v���܂����C�R�����������s��Ȃ���Ȃ�Ȃ��p���t�B���ؕЂ́C�V�����R�[�e�B���O�X���C�h��p����ׂ��ŁC���������L���̕K�v���Ȃ��������w�ł����Ɓ������V�������悢�̂ł����C�����ؕЂ�זE�f�p�ɂ��́������V�����R�[�g�̃X���C�h�K���X��p����̂͋֊��ł��D�Ƃ����܂��̂́C�������V�����R�[�g�X���C�h�́C�}���`�R�[�e�B���O�X���C�h�ɂȂ��Ă��āC�V�����R�[�g������ɁC�X�ɐؕЂ�L�т₷������R�[�e�B���O�����Ă���C�p���t�B���ؕЂł��ƒʏ�C�������ؕЂ���F����O�ɔM�������܂��̂ŁC���̍ŏ�w�̃R�[�e�B���O�܂��n���āC���̉��̃V�����ƐؕЂ����łɒ���t���̂ł����C�����ؕЂ�V�N�זE�ޗ��ł́C�ʏ���F�O�ɂ��̂悤�ȔM�����͍s���܂���̂ŁC�������̃X���C�h�K���X�ȏ�ɁC�ؕЂ܂��͍זE��������Ă��܂��܂��D�i�v���ӂł��j���������āC�����ؕЂ�V�N�זE�ޗ��ɂ́C�V�����R�[�g�݂̂̃X���C�h�K���X��p����ׂ��ł��D�i����قǔ�����Ȃ����̂Ȃ�C�������̃X���C�h�ł��悢�Ǝv���܂��j�V�����R�[�g�X���C�h�́C�s�̂Ŏ�ɓ���܂����C����i���ȒP�ɏo���܂��D�Ȃ��C�������V�����̂悤�ɐL�тāC�������V�����P�Ƃ̂悤�ɁC�M�����Ȃǂ��K�v�����̂��ǂ����Ă��K�v�Ȃ�C�V�����R�[�g������ɁC����ȊE�ʊ����܌n�̎���ŏ���������C�M�����������ɗǂ��L�тėǂ��\��t���X���C�h�K���X���o���邻���ł��D�i�܂������Ă��܂���j
�ԐM�@�V�����ɂ��āB�܂��A�P�C�fSi�́A�Y�fC�Ɠ����������̎��4�{�����Ă��܂��B�V�����Ƃ����������͎��̂悤�ɕ\����܂��B
�@�@�@�@�@�g
�@�@�@�@�@�b
�@�@�@�g- �r��-�g
�@�@�@�@�@�b
�@�@�@�@�@�g
�����̑f�q�����ɂ͌������Ȃ��K�X��Ԃ̉������ł����A����ŒY�f�̏ꍇ�ƈ���Ă��̉������A�ƂĂ��s����ŁA10���N�O�ɂ͍��Ŕ������̂��N�����Ă��܂��B4�̐��f�g�����S�Ɋ��\��i�q�j�Œu�����������̂́A���������Ȃ��Ȃ�A��ʂ̉��w����Ƃ��Ďs�̂���Ă�����̂���������܂��B���\��́A���f�b���Ƃ��i�n�l���j,�i�n�d���j�Ƃ������A���R�L�V��ȂǂŒu�����������͔̂������������A��舵�������E���܂��B����A���̊��\��Œu�������������́A�V�����܂Ƃ��Ă̋@�\����傫�����E���܂��B�K���X�ɃV�����܂�h�z�����ꍇ�̖͎��}�́A
�@�@�@�@�@�@�@�@�q �@�@ �q �@ �@�q
�@�@ �q �@
�@�@�@�@�@�@�@�@�b�@�@�@�b�@�@�@�b�@�@�@�b
�@�@�@2�i�g�n�j-�r��-�n-�r��-�n-�r��-�n-�r��-�i�n�g�j2
�@�@�@�@�@�@�@�@�b�@�@�@�b�@�@�@�b�@�@�@
�`�`�`�`�`�`�`�`�n�`�`�`�n�`�`�`�n�`�`�`�`�`�`�`�`�`�`�`�K���X�\��
�Ƃ܂��A�K���X�\�ʂ̃V���m�[����i�r��-�n�g�j�ƃV�����܂��ꕔ�������A�܂��A�V�������̂����݂��d���������āA�R�[�e�B���O�����ł��܂��B���̃R�[�e�B���O���̐����́A���\��i�q�j�̐����ɂ��܂��B�����A�V�����܂Ƃ��āA���\��i�q�j�������͂������̂悤�Ȃ��̂Ȃ�A�������������܂��B���\��i�q�j�Ƃ��ċ�̓I�ɂ́A���`����b�g3,�u�`����b4�g9,�I�N�`����b8�g17,�I�N�^�f�V����b18�g37�Ȃǂ��l�����܂����A���ۂ̑g�ݍ��킹�͂킩��܂���B��������̂����}���`�R�[�g�Ƃ͂ǂ̂悤�ȍ�ƍH���ōs���Ă�����̂��A�悭�킩��܂���N�����V��������уV�����ƌĂ�Ă���K���X�R�[�e�B���O�̍�p�@���͊��\��(R)�̈Ⴂ�ɂ��h�����Ă�����̂ł��B�܂�A���\��M�ɂ�銈���������A�e����������������̂�N�����V�����ƂȂ�킯�ł��ˁB���̐e����(�Ⴆ��-OH��Ȃ�)�����Ƃ������Ƃ́A���n�}���ł͊��\��Ƒg�D�`�����Ԃɐ����q��������Ă��܂����Ƃ��Ӗ����Ă���A����̔����̂悤�ɍזE�E�v���f�p�ɂ͌����Ȃ��Ƃ���������Ă���Ǝv���܂��B�W�{�쐻�ߒ��́A�{�݊ԍ������肷�ׂĂɌ����邱�Ƃł͂Ȃ��Ǝv���܂����A�����𗝉����g�p���邱�Ƃ͉����ɂ����Ă��d�v�Ȃ��Ƃ��ƍl���Ă��܂��B�o�����Ɖ��w���_�̗Z���������A�ߑ�a���Z�p�̐i�ޓ����ƌl�I�ɂ͎v���Ă��܂��B���Ȃ݂ɁA�V�����R�[�g�K���X�Ƃ������̂̓V�����P�̂��`�����Ƃ̌�����p������̂��Ɗ��Ⴂ���₷���̂ŁA����������₷�����̂ł��ˁB�֑��@�����Ԃ̃K���X����������(���C��
X,�����R�Ȃ�)��R-�V�������g�p����Ă��܂��B�����̐��i���ł�O�ɂ�poly-L-���W���ܗL�Ȃ�Ă������i������܂����ˁB
�ԐMN���� Silane�̃}���`�R�[�e�B���O�Ƃ��������́C�K�������K�ł͂Ȃ���������܂��C�������w����̐����ł́C�m�����̂悤�Ȃ��Ƃ������Ǝv���܂��D�i�����C�ڍׂɂ��Ă͊�Ɣ閧�Ƃ̂��Ƃł����j
�ԐM�@�����{�݂ł͔�������B�̓d����U�m�R���g���Ă��܂��B�d�����Ɛn�̕������������Ă���̂Őn�̕������Ɛ��ł���̂������ł��B�I�v�V�����Őn�̕����ɋz���t�[�h�����t����ƍ��������z������Ă����悤�ɂȂ�݂����ł��B�i�������j�T�������@�ł������悤�Ȃ̂�����悤�ł��B�[�d���ɂ�����n�̉����Ɠd�����ł��Ȃ�d���Ȃ��Ă��܂����Ȃ�r�͂��K�v�ɂȂ�̂ł́B�o�C�I�n�U�[�h�Ɋւ��Ă̓A�����J�����Ȃ肷����ł���̂ŃA�����J�̃T�C�g�ŒT���Ă݂���ǂ��ł��傤�B
�ԐM�@���������Ƃ��肩������܂���ˁB�ŋ߂̑�H����́A�[�d���c�[����G�A�c�[�����g�p���Ă���̂ŁA�����ǂ����̂͂Ȃ����Ǝv�������x�ł��B
�ԐM�@����̓X�y�V���������}���`��v�]���Ă���̂ł��傤����(*_*)�B
���͍��N�ŋΑ�15�N�A�a��������l�ł��B��ʎЉ�ł́A���ꕔ����15�N������ƒ��x�e�����̃��b�e�����\����悤�ł����A�����ɂ͂��̂悤�Ȏ��o�͑S������܂���B�a���Ƃ����E�킪���̂悤�Ɏv�킹�Ă����̂��A�����������������Ƃɖ��ڒ��Ȃ̂��A����̓����ɕ����Ă����l�̓������Ԃ��Ă��܂��B�m���Ɏ������x�����[�e�[�V�������������Ǝv�������Ƃ�����܂��B�a���n���͂��₾�A�Ǝv���Ă��܂����B��������A�Ⴄ�����ŐV�������Ƃ��o���Ď����̒m���Ɍ��݂��������悤�Ǝv�������Ƃ����x������܂��B�������Ȃ���A���ۂɕa���𗣂��ƂȂ��CT�����Ȃ����߂ɁA�@���̍זE�f�͂ǂ�����̂Ƃ��a���V�X�e���̕ێ�͂ǂ�����̂Ƃ��A��U�͂ǂ�����̂Ƃ���������������̂��������āA���̕����Ƀ��[�e�[�V�����ł��Ȃ��̂�����ł����B���̂悤�Ȓ��A�n��̐��x�Ǘ��Ɩ��Ɍg��邱�ƂŃ��[�e�[�V���������邱�ƂȂ��A�l�X�ȕ��������������m���̋z�������邱�Ƃ��ł����͕̂s�K?���̍K�����Ǝv���Ă���܂��B���ł́A�Տ����w���͂��ߍہA�A���ɂ�����܂ŁA���̓��̃v���������߂�y���݂������A�a���ɋ��Ȃ���ɂ��đ�����̒m�����z���ł��鋫���ɖ������Ă��܂��B�������A���ǂ��͓����E�����������ʂ̌��̂ɐG���@��͖��ł͂���܂���B���X�l���������邱�Ƃ���������܂��B�L���B���L���A��
��������Ɛ[�������b�g�[�Ɋ撣���Ă��܂��B�����A�a���ɔz������Ĉ�ԃC�����������Ƃ́A�Z�����Ă�����̋Z�t����ɂ͂��̖Z�������`���Ȃ����Ƃł����B�Ȃɂ��ɂ��āA�a���̓q�}�������Ƃ��A�������ɂ�����t���Ȃ��ėǂ�����y���ˁB�Ƃ��B�m���ɂ��̂悤�ȗv�f������܂������ۂɂ͖Z�������A�q�}�Ȃ���܂���B���F�̑҂����Ԃ����Ē��r���[�����A��������̏�����ǂ܂Ȃ���Ȃ�Ȃ����E�E�E�B��҂Ƃ������H���ł���Ă����Ȃ���Ȃ�Ȃ����E�E�E�B�ȂNj������炫�肪����܂���B�a���Z�p�҂łȂ���Ή�����Ȃ��Y�݂�����Ă�����X�������ł��傤����A���̃��[�����O���X�g�����̂悤�Ȑl�̂��߂ɂ��A�������ɂ��Ă�Ηǂ��ƍl���Ă��܂��B
�ԐM�@���@�ł́C�a���̊e�������l�b�g���[�N�Ō��сC���̊ԂɃT�[�o�[��u���C�p�X���[�h��3�d�ɂ��C�f�[�^�̃o�b�N�A�b�v��CD-R�ōs���Ă��܂��D�������C�����ꂽ��Ԃł̃l�b�g���[�N�ł͂Ȃ��CCATV��LAN�Ȃ��߁C�Z�L�����e�B�����S���Ƃ͌�����܂���D�܂��C�����R���s���[�^���̂��̂��s���S�ȑ㕨�ł��邱�Ƃ���l����ƁC�f�[�^�̃o�b�N�A�b�v�Ƃ������Ƃ����ɂȂ��Ă���Ǝv���܂��D�Z�L�����e�B�ƃo�b�N�A�b�v���āC�l���Ă݂�ƁC�ɂ̑��݂̂悤�ɂ��v���̂ł����c�B�f�W�^�������邱�Ƃɂ���āC�֗��ɂȂ锽�ʃ��X�N��������Ǝv���̂ł����c�B
�ԐM�@���@�ł́A���N�O�Ɏ����}�C�N���\�t�gACCESS�ō�����A����V�X�e�����g���Ă��܂��B�\���ݗp���Ȃǂ̒��[�ނ͎���p���āA�摜(�\���݁E���ʗp����)�͐�p�̃t�@�C�����O�V�X�e���ōs���Ă��܂��B���҂̃����N��LAN�ɂčs���Ă��܂��B�Z�L�����e�B�[�Ɋւ��ẮA����V�X�e���ł��邽�߂Ƀ����[�V�������ׂ���������\���ɂ����̂ʼn�ǂ͓���ł��傤�BACCESS�ɂ̓f�[�^�̈Í��������Ă����@�\������܂��B�܂��A�Â�ACCESS���g�p���Ă���̂ŁA�t�@�C���𓐂Ƃ���ʼn{���ł��܂���B�@���l�b�g���[�N�ɂ��ڑ����Ă��܂����A�l�b�g���[�N���̂̃Z�L�����e�B�`�F�b�N������̂ł�������Ƃ͓���܂���B�������A�@�O�Ƃ͎Ւf����Ă���̂ʼn@���n�b�J�[������Εʂł����A�N���͂ł��Ȃ��Ǝv���Ă��܂��B�a���͊�{�I�ɂ̓X�^���h�A�����̕������S�Ƃ����Έ��S�ł���ˁB���́A�����V�X�e���������Ă��܂��āA�����NEC��PC-LACS�Ƃ������{�V�X�e�����g���Ă��܂��B��������A�@�O�Ƃ͎Ւf����Ă���̂ʼn@���n�b�J�[�ȊO�͐N���ł��܂���B�܂��A�����WINDOWS
NT4.0 SERVER�Ȃ̂ŃZ�L�����e�B�[�`�F�b�N���Â��W��A�J�ɗ��s���Ă���E�C���X�n�\�t�g���N�����Ă����v�Ȃ悤��Web�֘A�̃l�b�g�V�X�e���͎g��Ȃ��悤�ɂ��Ă��܂��B�������A�d�q���[�����g�p���܂���B�l�b�g�֘A�̃C�^�Y����Web�֘A�̃t�@�C��(�T�[�o�ɑ��݂���)�ɑ��čU��������̂�������ł��B�������j���_�Ȃǂ̃E�B���X�ɂ͖����ł����E�E�E�B����������A���̊ԁA�a�@�ŃE�B���X�\�t�g��z�z���Ă܂����˂��`�B
�ԐM�@���@�ł́A�d�q���J���e�ɂނ��ĕa������̓d�q����ڎw���Ă��܂��B�ꉞ�A�X���Ɏ��{���߂����Ă��܂����A���X�̖�肪........�B��͂�A�Z�L�����e�B�ł��B�p�X���[�h�͂Q�d�ŁA�d�q��Ӂi�����҂����I�j�Ȃ���̂�USB�ڑ��ɂ���ď��߂āA���͏o����悤�ɂ��Ă��܂��B�v�����g�A�E�g�́A�N���A���������ɂ������L�^�Ɏc��悤�ɂ��Ă���̂ł���,,,,,,�B�\�t�g�̓t�@�C�����[�J�[Pro�ł��B���ꂾ�ƁA�r�d�̕����s�[�����ƒf�����Ă��܂����B�u�s�̂̃\�t�g���ƁA��͂���E������v�ƁA���ґ����͉@��LAN�ɗ����Ă��܂��B�����A�o���ɂ�������Ƃ������S���I����Y�܂��Ă���̂ł����B��͂�A�R�X�g�̖�肪����ł��܂��B�o�b�N�A�b�v��CD-RW�ł��B���R�Ƃ��āA�c�����������Ǝv���܂����A�ǂ��Ă�����E�E�E�E
����@�Ɖu���F�̎�Z�ŃA�h�o�C�X���������Dcyclin D1�̐��F�ŁA�o�b�N�i�זE���j�̂������F���X�L�b�g�ʂ��Ă���܂���D�j�����C�̊�ߍςݍR�̂��g���Ă��܂����A������Q�{�A�T�{�ƍX�Ɋ�߂��āE�E�B
�����X�b�L�����Ă����̂ł����E�E�Ƃ肠����10�{�Ƃ�����ȏ�H������Ă݂邩�I ���炢�����v�����Ȃ��ł���܂��D ����́AENVISI�����gD����O�h�AMAX-PO(MULT)�g�j�����C�h�ŁA�o�b�N�̂ʂ��Ɋւ��č��͂Ȃ��悤�ł��D
�ԐM�@���R�̂̊�߂Ɋւ��Ă̓��[�J�[��ߍς݂̂��̂͒ʏ�Z���߂Ȃ̂ő�����߂��Ă����܂�܂����A���[�J�[���ł͂��܂����ė~�����Ȃ��悤�ł��ˁB��ߍς݂͗Ⓚ�ۑ����ł��Ȃ��̂ŁA��߂����Ɏg���ĕۏ؊��ԓ��Ɏg����A�V�������ɔ��������čs���������肵�����F���\���Ǝv���܂��B�i���܂���F�p�x�������Ȃ��̂ł���A����߂̕����w�����ėⓀ�ۑ����āA�g�p����߂��������ǂ����Ǝv���܂��B�j���Ƃ͔������Ԃ�Z�����Ē�������Ƃ����̂͂ǂ��ł��傤�B�j�����C�̊�ߍς݂Ƃ������Ƃł����A���ۂ�ZYMED�Ђ̐��i�ł��ˁB������ƕs�v�c�Ȃ̂�Z��MED�Ђ̃J�^���O�ɂ̓N���[��AM29�͂���̂ł����AZY-7D2�͏o�Ă��Ȃ��̂ł��ˁB���{���蔭�����H���\���₵���ł��ˁB���R���������������{���Ă���Ǝv���ł����A���̏������Ԃ��o���邾���Z���Ԃɂ���ƃo�b�N��������X��������܂��B�܂�cyclin
D1�Ɋւ��Ă̓N�G���_�ɏՉt��pH��6.0�ł͂Ȃ�7.0�̕����ǂ��Ƃ��Ă���_��������܂��ˁB��cyclin D1�̂悤�Ȋj���R���͂��Ƃ��ƍזE���Ń^���p�N���������ꂻ�ꂪ�j���Ɉڍs���ċ@�\��������̂ł����A��ᇂȂǂ̂悤�ɂ��܂�ɍזE���ł̍���������ɂȂ�����A�j���ڍs���j�Q���ꂽ�肷��ƍזE���ɂ����܂��āA�זE���ɂ����܂��Ă��邱�Ƃ��܂܂���܂��B�ŋ�p14���������Ă܂����A���낢��Ȏ{�݂̕W�{����F����Ɗj�����Y��ɐ��܂�Ƃ��������Ίj�ƍזE�������Ƃ����܂��Ă���Ƃ��낪����܂��B�ǂ����Œ�����ɂ���Đ��F�����ς��悤�ł��B
�ԐM�@�����ɂ��肪�Ƃ��������܂��D�������E�E�������Ԃ�Z������肪����܂��ˁD�E�E��߂��Ȃ������ǂ���ł����ˁD�ʏ�A�ꎟ�R�̂͂P����(����)���A�I�[�o�[�i�C�g�i4���j�Ŕ������Ă��葼�̍R�̂Ɠ����X�e�b�v�Ői�߂邽�߂Ɋ�ߍς݂̂��̂�����ɓ���Ȃ��i�H�j�R�̂ł͉䂪�Ƃ̎��K�Z�x�H�I�Ŕ��������Ă��܂��iCAM5.2�j�D�R�̂̊�߂ɂ�D����O�̉��Ƃ������ΐF�����R�����ȏ�͎g����Ƃ�������߉t���g���Ă��܂��D���̕a�@�ł�cyclin
D1���ǁ[���ˁ[�A�Ƃ����Ă��āA�o�b�N���o�₷���R�̂Ȃ̂��ȁ[�ƁA���R�Ǝv�����肵�Ă��܂����D�z���R���g���[���Ɠ����悤�ɉA���̐ؕЂ̍זE�����������F�ɐ��܂��Ă��܂��A�䂪�Ƃ͂��܂�����ق������ł��Ȃ���ԂƎv���Ă��܂��D�R���̕�������pH.7.0�̃N�G���_�ɏՉt�Ńj�����C����̃p���t���b�g�̎w���ɏ]���Ă���Ă��܂��D�������̎��Ԃ̌����͂��̌��ʂƂ̂��߂������Ō��Ă����Ηǂ���ł���ˁD����Ă݂܂��D
�ԐM�@���@�ł́C�T�C�N����D1�́CIB���Ё��_�C�����g�����̂��̂��g���Ă܁[���Dclone���́C�����������ȁ[(?.?)�@���C�ƂȂ̂ŕ�����܂���c�i�Y��܂����j�R�������́CEDTA(pH8.0)�ł���Ă��܂��D�N�G���_�ɏՉt�ipH7.0�j�́C�R�������p�ɍ���Ă͂���܂����C�܂��g�������Ƃ�����܂���D�_������̘_���ł́CEDTA�Ɠ����x�̕������ʂ�����C���C�ؕЂɂ₳�����݂����ł���ˁ[�c�B�m���ɁCEDTA���g���ƁC�ؕЂ�������₷���Ȃ邯�ǁC�g�C�����h�Ő��߂Ă��܂��D�T�C�N����D1���āC�����Ȃǂ̊j�ɂ͂悭���܂���ǁC�}���g���]�[�������p��ɂ͂Ȃ��Ȃ����܂�Ȃ��̂�ˁ[(?.?)�@���@�ŁCfollicular
lymphoma��������small medium size��B-cell lymphoma��100��߂����߂����ǁC�j���Y��ɐ��܂��Ă����̂́C�Q�`�R��ł����D�����Ƃ��C���̒��̂����������ႪMantle
zone Lymphoma�������̂��́C������܂��CHE���F�ŁC���炩��Mantle zone�R���Ǝv����Ǘ�ł��C���܂��Ă��Ȃ����̂�����܂����D����ς�C�Œ�Ƃ��C�l�X�ȗv���ɂ���Đ��F�������E����Ă���̂��Ǝv���܂��D
�ԐM�@���o���ɂ���čČ������ۏ���Ȃ��Ƃ������Ƃ��킩���Ă��Ďg�p����̂Ȃ炩�܂�Ȃ����Ǝv���܂��B�ǂꂭ�炢��߂��Ă����v���Ƃ����̂́A�R�́A�Ǘ�ɂ���Ă��ς���Ă��܂��̂ŁA�����Ō�������K�v�����邩�Ǝv���܂��B��Antibody
Diluent�ł��ˁB�����ł��g���Ă��܂��B�����{�݂ł�cyclin D(1)�Ƃ��Ă�UpXXtate Bio.(poly)�ANovoXXstra(DSC-6)�APhamXXgen(G124-326)�AIBX(5D4)�ASXXta
Cruz(poly)������܂��B���̒��ł�NovoXXstra(DSC-6)���ł��ǂ������悤�ȋC�����܂��B����DSC-6�Ƃ����N���[���͔�r�I���낢��ȃ��[�J�[�ŋ������Ă���̂Ŕ�r�I���S��������܂��ˁB��ʓI�ɓ����R���ɑ���R�̂ł��N���[�����قȂ�Ɛ��F�����ς�邱�Ƃ͂܂܂���܂��B�t�ɃN���[���������Ȃ烁�[�J�[���قȂ��Ă����F���͂قړ����Ȃ̂ōR�̂��w�����鎞�ɂ̓N���[������I�Ԃ��Ƃ��厖�ł��ˁB�|���N���ł̓��b�g���ɋC��t���ĉ������B���b�g�ɂ����F�����ς���Ă��܂����Ƃ�����̂ŁB> �z���R���g���[���Ɠ����悤�ɉA���̐ؕЂ̍זE�����������F�ɐ��܂��Ă��܂��A�䂪�Ƃ͂��܂�����ق������ł��Ȃ���ԂƎv���Ă��܂��D
������͊j�ɐ��܂����z���זE�̍זE���ɔ������܂��Ă������ł͂Ȃ��j�ɗz�������Ȃ��זE�̍זE���ɂ����܂��Ă���Ƃ������ƂȂ̂ł����ˁB�j�ɐ��܂����z���זE�̍זE�����������܂��Ă��邱�Ƃ͌��\����̂ł��̂��Ƃ������Ă���̂��Ǝv���܂����B���������Ӗ��ł͍זE���������܂��Ă���悤�Ȃ��Ƃ͖��������Ǝv���܂��B
�ԐM�@�ꎟ�I���}�[�J�[�ivimentin�CEMA�CS-100�CNSE�Ȃǁj�͓e���p�C�a����ɂ���āC�I���}�[�J�[�i���ׂ������ނ��邽�߂̍R�́j�͂��Ȃ�قȂ�Ǝv���܂��D�Ⴆ�C������n�}�[�J�[�Ȃǂł́CCGA�����ŏI����Ă��܂��搶������CCD57�CCD56�Csynaptophysin�Cneurofilament�c���X�C������n�}�[�J�[�Ƃ�����قƂ�ǂ�order���Ă���搶�����܂��D����ŁC�O���I���}�[�J�[�i����p�j�ƂȂ�ƁC�܂����܂������́i�Ⴆ�C���[�C���O����̂Ƃ���CD99�C�b��B���l���̂Ƃ��̃J���`�g�j���c�Ȃǁj�ɂȂ��Ă��܂��D����������order���C���̈ꎟ�E�E�O���I���}�[�J�[�̃~�b�N�X�ƂȂ��Ă���̂����{�݂̌���ł��Dkeratin�ЂƂƂ��Ă��CKL-1�CWSS�����̐搶������C�������g�킸�CAE1/AE3��CAM5.2�C34��E12�Ƃ����搶��CCK1�CCK5�CCK6�CCK7�CCK8�CCK9�CCK10�CCK13�CCK16�CCK17�CCK18�CCK19�CCK20�Ƃ����搶�����āi�Ǘ�ɂ�����ł��傤���ǁc�j�C�ƂĂ����G�ł��D���ɁC���@�̕a�@�a���Ȃ̋����́Clymphoma�����Ȃ��߁Clymphoma
susp���ƁC�K��20��ވȏ�̃����p�n�}�[�J�[���s���܂��i���{�݂ł͂���������p�Z�b�g�ƌĂ�ł��܂��j�D�ł��C��w�E��ÊE�̓~�̎���Ƃ�����e���ł��傤���I�H�C���@�ɂ����ẮC�ߔN�C�V�����R�̂����܂蔃���Ă���Ȃ��Ȃ��Ă��܂����D�������Ȃ��C�V�����R�̂́C�a�@�a���Ȃ��͂��߂Ƃ��āC�e�f�ÉȂ̌�����ōw�����邱�Ƃ��C�����Ȃ��Ă��܂����c
���C�s�̂ŏo����Ă��鐔����Ȃ��R�̂���C�K�v���L�p�Ȃ��̂�I�ʁE�w�����C������ێ��E�Ǘ����Ă����̂͑�ςł���ˁ[�H�����ŁC�F����Ɉ��Ă�����܂��D���܂ɂ����g��Ȃ����ǁC�K���ǗႪ�o���Ƃ��́C�Ȃ��ƍ���݂����ȍR�́i1�{��������ꐶ����݂����ȍR�́j�C�Ⴆ�Cmelanoma��HMB45�CALCL��ALK/p80�C�������osteocalcin�c�Ȃǂ��C�ǂ����ň�{��������C�W�{�݂ŕ��������i���̑���ɁC��������{�݂́C�����������������̍R�̂�����C��͂�W�{�݂ɕ��z����j�Ƃ������l�b�g���[�N�V�X�e����n�����炢����Ȃ����Ǝv���̂ł����C�F����ǂ��ł��傤�I�H�܂��C�g���̍R�̂��Ȃ肢���݂��������ǁC�F����g���Ă݂�[!?�h�݂����ȁc�����ɃV�X�e�����ł���Ƃ͎v��Ȃ��ł����ǁc�܂��C���̃��[�����O���X�g�����p���āC�g�����ŁC����ȏǗႪ�o����ł����ǁC�����R�̂ǂȂ�������������Ȃ��ł����H�������班�������ĉ������܂��[�H�h�Ƃ��C�g�����ŁC����ȏǗႪ�o���̂ł����ǁC���������}�[�J�[����܂��[�H�������班�������ĉ������܂��[�H�h���ĂƂ����珉�߂Ă�������Ȃ����Ǝv����ł����ǁc�܂��C���̃��[�����O���X�g�ɂ̓��[�J�[�̕����Q�����Ă���������̂ŁC���[�J�[�̕��ɂƂ��ẮC���܂������b����Ȃ��Ǝv���܂����ǁc�i�j
�ԐM�@���ǂ���Ăł��ˁB�_�ސ�a���ȂǂɏǗ���o���ƁA���̈��̂��߂ɍR�̂����肷���ł���ˁB����Ȉ���g���Ă��Ȃ��R�̂����낲�낵�Ă��܂��ˁB���邢�͎g������Ŕ����āA�C���ς���Ė��J���̂��̂�...�I�I�ς���ς����Ă��܂�R�̂�����500��ނł���B�����{�w�����Ă���̂����邩��600�Ƃ��A�R��1�{�����~�Ƃ��ā�000���ł���B�������[�J�[�ɍv�����Ă��܂��ˁB
�ԐM�@�܂��C�ŏ��́C���̃��[�����O���X�g���g���āC�e�ǂȂ����C�����R�̂��邢�͂����}�[�J�[����������[�Ȃ��ł����[�H�f����n�߂��炢����Ȃ����Ǝv���̂ł����c�B������i�́C����ϕa�@�ԃ��[���ł����ˁH�i���ꂪ�����ʓ|�ł��ˁI�j���A���^�C���ɂ���ɂ́C���낢��Ɩ�肪���邩�ȁH�܂��C��肠�����C�n�߂Ă݂܂��[�H�@������C�ǂ��̎{�݂ɂǂ�ȃ}�[�J�[�����邩���f�[�^�x�[�X���o�����炢���ł��傤�ˁ[�I�H�i���낢��Ɩ��͂���ł��傤���ǁc�j
�ԐM�@�Ƃ���ŖƉu�g�D���F�ł����A�����܂ōR�𑵂̂���̂��ȁE�E���āA�l���Ă��܂��D�䂪�Ƃ̂悤�Ȓ��K�͂̑����a�@�ł��p���t�B���ؕЂŐ��߂���R�̂������āE�EM�DLymphma�����E�E�CCarcinoid�����E�E�ƃI�[�_�[�������莝���̍R�̂̎�ނ����������ł��D�a�@�̐��i��a����̊W�͂���Ƃ��ĊF����̂Ƃ���ł͂������ł����D
�ԐM�@���݂܂���A���z���}�����ɋÂ��Ă��܂��Ď֑��I�Ȕ��\�ɂȂ��Ă��܂��܂����ˁB���̂悤�Ȗ�ł�����̏�œ��_���Ă�����Ă��\���܂����B����̐_�ՋZ�_�ސ�w��̌��ł������e�͂Ƃ����܂��ƁA�܂��ɏ㕶�̂Ƃ���ł��B���[�͂Ƃ����܂��ƁA�z���}������DNA�̃����_����Œ肷��̂�����ɏՍ܂Ɋ܂܂�郊���_�����Ƃ��������Ă��������낤�ƍl�������̂ł��B���ۂɁA�����_�i�g���E������������ƃA���f�q�h���o����ł���V�b�t�̋z���x���ቺ���܂����B�܂��A��������^�Ƃ������̂Ȃ̂ł����E�E�E�B������̌��ł����A���@��20%�����ɏՃz���}�����ł��悻5%���x�̌���(���ʐ�����̎Z�o)�ł����A�܂�15%�Z�x������ł͂Ȃ����ƍl���Ă��܂��B�]����20%�����ɏՃz���}�����Ɋւ��Ă͏]����10%-20%�z���}�����̍œK�Œ莞�ԂƓ��l�ɍl���Ă�����ėǂ��Ǝv���܂��B�Œ�t���̃z�����A���f�q�h�����͒ʏ�ł��ߏ�ʂ������Ă���̂őS�����͂Ȃ��Ǝv���Ă��܂��B���Ԃɂ��Ă͂��낢��ƍl�����邱�Ƃ�����܂��B�������A���퓙�ɂ���Ă��܂��܂����Ƃ͂������܂����A�Z���Ԃ���ΌŒ�Ƃ��Ă͏[�����Ǝv���܂�(���@�ł͖ؐ��u���b�N�ɂ���̂��ߌ��߂̑g�D������)�B���Ȃ݂ɁA���@�ł͐����ޗ��͂P���Ԓ��x�̂��̂����݂��܂�(���@�ł͗�������{�Ȃ̂�)�B�������A10%�����ɏՃz���}�����ɂ��ẮA��͂�A���f�q�h�̌������݂���ł��傤���炩�Ȃ蔖���n�t�ł̌Œ�ɂȂ�\���͔�߂Ă��܂��B�ȑO�ɋ���F�Ŏ_�����Ԃ̈Ⴂ�ɂ����F���̌���������ƌ���������ł����A�Œ莞��(�z���}����)�̈قȂ錟�̂ł́A�_���ɂ��g�D�j��ɗv���鎞�Ԃ��قȂ邱�Ƃ��킩��܂����B���e�́A�Œ莞�Ԃ̒Z�����͎̂_�����Ԃ�����Ƒg�D�Z���������A�����ԌŒ肳�ꂽ���̂͒����_�����Ԃŏ��������Ă����قǑg�D�Z�����݂��Ȃ������Ƃ������̂ł��B�z���}�����Œ�Ƃ́A���`�����ˋ��\���ɂ��`�����̎O�����\���̕ω��ƂƂ炦�Ė��Ȃ��Ǝv���܂��B��������������m�̂Ƃ���A���w�����ɂ����Ă͈���Ȍ��������Ƃ������̂����݂��܂��B�������A���ۂ̔����ɂ����āA�����Ɠ����Ɉ���Ȍ��������ɂȂ�̂ł͂Ȃ�������x�܂Őڋ߂��Ă���ȍ~�̓W���W���ƈ���ȃ��C���ɏ���Ă����̂ł͂Ȃ����Ǝv���܂��B���l�Ƀz���}�����ł̉ˋ���`���[���������͈���ȕ��q�ԋ����̃|�W�V�������Ƃ�܂łɂ͗\�z�ȏ�Ɏ��Ԃ���������̂ł͂Ȃ����ƍl���Ă��܂��B�������A���Ԃ��Z���ł�����ȕ��q�ԋ����ɂȂ��Ă��Ȃ��Ă��a���f�f�ɂ����Ă͖��Ȃ��ꍇ�������Ǝv���܂��B
�ԐM�@�����肪�Ƃ��������܂����D�ڂ������Ƃ́C�w��\�̂Ƃ��ɂ��������邱�Ƃɂ��܂��D���{�݂ł�20%�ɏՃz���}���������[�`������щ�U�̌Œ�I�Ɏg���Ă���܂��D�����Ƃ��C���Ɛ��ł͂Ȃ��C���{�^�[�i�[�́g�}�X�N�h�z����PH�h�Ƃ����̂�p���Ă��܂��D1990�N���CPCNA�̋Z�p�I�Ȍ��������Ă����Ƃ���C�Œ�t�Ƃ��Ă�PFA�܂��͊ɏՃz���}�������悢�Ƃ������ʂɂȂ�C����ȗ��C�ɏՃz���}�������g�p���Ă��܂��D���̓����́CMIB-1�Ƃ����o��ȑO�C�������M���E���M�����ɂ��R�������������\����Ă��Ȃ��i�蒅���Ă��Ȃ��j����ł����̂ŁCPCNA���O���u�Ȃ��̃z���}�����Œ�p���t�B���ؕЂŌ��o�o����B��̑��B�זE�}�[�J�[�ł����D����܂ŗp���Ă�����ɏՃz���}�����i�z���}�������j�ł́CPCNA�̔������x�����Ɏキ�C�������Œ莞�Ԃɍ��E�����Ƃ������Ƃ�������܂����D����C�ɏՍ�p�����������z�����A���f�q�h�n�Œ�́C�������x�������C�܂����܂�Œ莞�Ԃɂ͉e������Ȃ��Ƃ������Ƃ�������C����ȍ~�́C���[�`���̌Œ�͊ɏՃz���}�����ɕς��܂����D���͉��M�����ɂ��R���������Ƃ����Z�p���g�����Ƃɂ��CPCNA�̌��o���x�����I��UP�����邱�Ƃ��\�ł����CPCNA��G0���ɂ����ʑ��݁iG1����`S���ɑ�������j���邽�߁C���M�������s���ƂقƂ�ǑS�Ă̍זE�ɐ��܂��Ă��Ă��܂��C���B�זE�}�[�J�[�Ƃ��Ă͌��������̂�����܂��D�����Ƃ��C���̏�Ԃ̂����ɂ܂��͖��Œ蓀���ؕЂ��C�E�ʊ����������C���̌�C�Œ肵�Ă�����F�����S���זE�i�����t�H�[�N�E���[�f�B���O�����DNApolymerase�̊����⏕���q�Ƃ��đ��݂���PCNA�́C���ł�complex���`�����Ă���C�E�ʊ��������ɒ�R����L����C����זE�j���ɗV���̏�Ԃő��݂���PCNA�́C�E�ʊ��������ɂ��זE�O�ɗ������Ă��܂��j��I��I�ɐ��F���邪�\�ł��D�l�ԗl�̌��̂Ɋւ��ẮC���B�זE�}�[�J�[�́CPCNA����ki-67�iMIB-1�j�ɂƂ��Ă����܂������C���������Ȃǂ̌��̂ł́CPCNA�͂܂��܂��������Ǝv���܂��D(MIB-1�͊�{�I�ɐl�ԈȊO�ɂ͎g���Ȃ��C�������CMIB-5�͓����ł��ꉞ�g����j������Ǝ֑��ł����D
�ԐM�@��MIB-5�̓��b�g�ATEC-3���}�E�X�p�Ƃ���D����O�Ђ���łĂ��܂��ˁB�ȑO��MIB-5�̘_�������������ɂ͂܂�TEC-3���s�̉�����Ă��Ȃ������̂ŋ����ɋ����������������ă}�E�X�Ō������܂������A�Ȃ��Ȃ��Y��ɐ��܂�܂���ł����B����Ɋr�ׂ�TEC-3�͔�r�I���肵�Ă��Đ��F���e�ՂȂ̂ł��ꂩ��}�E�X�̑��B�}�[�J�[�Ƃ��ăX�^���_�[�h�ɂȂ肤��v�f�������Ă��܂��B�������������ŔN���ɂ܂Ƃ߂�ꂽ��ǂ��ȂƎv���Ă��܂��B�זE���x�����ƈ�T�Ԉȏ�GO�Ɏ~�߂Ă����זE�ł�PCNA�͔����ȏ�Ō��o����܂��B�זE���x�����Ƒ��B�Ƃ͖��W�ȃ}�[�J�[�ł��ˁB�l�̑��B�}�[�J�Ƃ��Ă�DNA
Topoisomerase II (MBL��)�����������ł��ˁB�ȑO�͓����ؕЂł������܂�Ȃ������̂ł����A��N�p���t�B���ł����܂�R�̂���������Ă�����Ɛ��F���Ă݂܂������A�悭MIB-1�Ƒ��ւ��銴���ł��BMIB-1�������芴�����邩�ł��B������MIB-1�Ɋr�ׂĈ����͂Ȃ����������ǂ����Ȃ��Ƃ����_�ŁA���̂Ƃ���MIB-1�Ő��F�����܂������Ă��Ȃ��Ƃ����{�݈ȊO����芷���郁���b�g�����Ȃ��̂���_���ȁB������Ǝ֑��֑̎��ł����B
�ԐM�@�ɏՃz���}�����ŌŒ肵�Ă����ƁC�d���ɂ��g����Ƃ������Ƃł����C���ۂɎ��������Ƃ͂���܂���D�ǂ��Ȃ̂ł��傤�H�܂��C�ꎞ���C�d�����K�v�Ȃ邩���m��Ȃ����Ƃ�z�肵�āC�����ɏՃz���}�����ɏ��X�̃O���^�[���A���f�q�h��Y���i1�`2���O���^�[���A���f�q�h�E�S���z�����A���f�q�h�E0.1M�����_�ɏՉtpH7.4�F�J���m�t�X�L�[�Œ�̕ϖ@�݂����Ȃ��́D���@�͂����ƁC�O���^�[���A���f�q�h�Z�x���Z�������悤�ȋC������c�j���C�Œ�E���̂܂ܗ①�ɂɕۑ����Ă����C�K�v�ɂȂ�����C�d���p�ɏ�������Ƃ������Ƃ�����Ă������Ƃ�����̂ł����C3���{���炢�܂ł�OK�������Ǝv���̂ł����c�i���\���������I�j�O���^�[���A���f�q�h���āC�W�A���f�q�h�Ȃ̂ŁC�V���̃A���f�q�h�c��c��Ƃ��ŁCPAS�Ƃ��ɂ͕s�����Ƃ������Ă����Ǝv���̂ł����C�l�I�ɂ́C�t�����Ƃ��ŁC���Ȃ蔖�������ؕЂł��V���[�v�Ȑ��F���������āC�t�ɂ�����Ȃ����Ǝv������ł����ǁc�B�ǂȂ��ł����H
�ԐM�@�悭�����グ�Ă���܂����B�������A�Տ������Ƃ����G���ɂ����e���Ă����܂�����ˁB�������Ɏ���PCNA����߂Ă��܂����B���@�͐̂��畐�����w��20%�����ɏՃz���}�������g�p���Ă������߂ɁANOVO��PCNA�̐��ߏオ��͂ƂĂ����������ɗǂ��R�̂��Ɗ����Ă��܂����B�������A��������̌������\���ɎQ�l�ɂ����Ă��������܂�����B�ł��A�܂��������ɏՃz���}�������ǂ����ʂ��Ă����Ƃ͎v���Ă��݂܂���ł����BPCNA�̘b�͂ƂĂ����ɂȂ�܂����B�����́�������̖��O�����͂悭�m���Ă��܂������A�܂������̂悤�Ȍ`�ł��t����������Ƃ͖��ɂ��v���Ă��Ȃ��������A����������Ȑl�Ԃ������Ƃ͎v���Ă��݂܂���ł���(;_;)�B�b�߂�܁`���B�����ɏՃz���}�����ɂ��Ă͂��܂胁���b�g�����������Ƃ͂���܂���ł����B�������A���@�ł́A���{�݂̕W�{����F����悤�Ȏ{�݂ł͂Ȃ��̂ŌŒ�t�ɂ���r���킩��Â炢�ł��B�ł��A����̘b���݂�ƖƉu���F�Ɋւ��ă����b�g�͂��肻���ł��ˁB�����v���̂ł����A���낢��Ȕ��\(�������܂߂�)�ŌŒ�t���ӎ����Ă�����̂͏��Ȃ��悤�Ɋ������܂��B�悭�A�a���̌�����factor���������čČ����������Ƃ����l�����܂����A��ԏd�v�ȌŒ�ɂ��Ă̈ӎ��������Ⴂ���߂�factor�������Ă��܂����Ƃ��l�����܂��ˁB�������������Œ�ɂ��ẮA���܂�l�Ɍւ��킯�ł��Ȃ��A�ǂ��@��Ȃ̂ł��낢�댟�����Ă݂悤���Ǝv��������ł��B�z���}�����ɂ��Ă͂��낢��ƕ������W�߂Ă��܂��B�������A���낢��ȕ����Ƃ̔��������̒��ɂ͏�����Ă��܂��B���̃��[�����O���X�g�ŏ������F����ɏЉ�Ă��������Ǝv���Ă��܂��B���낢��ȕ����Ƃ̔����������ׂĂ������ƂŁA�z���}�����Œ�̋@�\����������������悤�ɂȂ邩������܂���ˁB
�ԐM�@>�d���ɂ��g����E�E�E�B�_���ł��ˁB���@�ł����������͂��̂悤�Ȃ��Ƃ��l�����ĊɏՃz���}�����ɕς�����ł����A�\�z�ȏ�ɑg�D�j�傫���ă����b�g�͊������܂���B�O���^�[���A���f�q�h�̍\������ OHC-CH2-CH2-CH2-CHO�@�ł����̃A���f�q�h���L����W�A���f�q�h�̕����ł��B���Ȃ݂ɍ\�����ł�CH2(CH2CHO)2�Ǝ�����Ă�����̂�����܂��ˁB���̓�̃A���f�q�h����-�A�~�m��Ɣ������Ē`�����̋���ˋ����`������Ƃ���Ă��܂��B������z���}������
H-CHO�ƈ�̃A���f�q�h��������m�A���f�q�h�̕����ł��B���q�ʂ̈Ⴂ����זE�̓��ߐ��ɂ̓z�����A���f�q�h�̂ق����D��Ă���Ƃ���Ă��܂��B���A�ˋ��`�����ᕪ�q�ł��邽�߂ɒ`�������u�c�u�c�ƈ�������Ă��̖��c�ȍזE�`�ԂƂȂ�܂��B�t�ɃO���^�[���A���f�q�h�͗��[�ɔ�����������߂ɁA�Ⴆ��Ȃ獽�Œ`�������K�`�K�`�Ɍł߂Ă��܂��悤�ȏ�ԂƂȂ�܂��B�܂��A���ɑ��݂��郊������(���̈ꎟ�A�~�m�_)�Ƃ����������ǂ����߂ɖ����②���j��Ȃ��̂ł��傤�B���̃O���^�[���A���f�q�h�̔����͓��`���ȂǂƂ̔������͗ǂ��Ȃ��悤�ŁA�����͖������̂܂ܘI�o���Ă���悤�ł��B����ˋ��Ƃ����Ă��A�����ɂ͔��ɏ��������̂ł���̂Ŏ��ۂɌ������ł͂Ȃ��̂ł����܂ł������I���߂�����ƁA�V���A���f�q�h�Ƃ̓O���^�[���A���f�q�h�̈���̃A���f�q�h���`���ƌ������A�����Е����s���s���ƗV�����Ă����Ԃ������Ă���̂��悭�킩��܂��A���̂悤�Ȃ��Ƃ͐��I�ɂ����ɏ��Ȃ��̂ł͂Ȃ����Ǝv���܂��ˁB����ɁA�s���s���Ƃ��Ă��邭�炢�Ȃ牽�����ɂ������Ă���ƍl�����ق������R�ł��ˁB���������ۂ�PAS���F���s���Ă݂Ė�肪�Ȃ������̂ł�����A��͂�V���̃A���f�q�h�͑��݂��Â炢�̂ł͂Ȃ����Ǝv���܂���B
�ԐM�@2.�́u�V���F�@�̂��ׂāv�̃~�X�v�����g����`�ˁB���̔䗦�Ŋ�߂����1%�Z�x�ɂȂ����Ⴄ�ˁB
�������ł��ˁB4�e�@�������ƍl����̂����R�ł��ˁB���̖{�ł�1.5���Ƃ����̂�����܂����B���S�~���E�o����n�������ۂɗn���Ȃ��Ŕ������a�����c������Ƃ������ƂȂ̂ł����ˁA����Ƃ��n�������ǂ��炭����ƒ��a�����͏o���Ă����Ƃ������ƂȂ̂ł����ˁB10���̕ۑ��t�Œu�����ςȂ��ɂ��Ă����ƌ������͏o���Ă��邱�Ƃ͂悭����܂����B��ԍl������͎̂���̗ł��ˁB�����̓S�~���E�o���������r��`���Ɖ��F���J�r�݂����Ȃ��̂��t�������̂��������Ă��܂��ˁB���_�S���ȁH�������ؕЂ��ƓS�~���E�o���߂ɂ���Ɨǂ��ꍇ������܂��ˁB�Ƃ���œS�~���E�o�����Đ���12�����������Ă���̂ł���ˁBFeNH4(SO4)2.12H2O���q�ʂ�482�����琅��45������߂邱�ƂɂȂ�܂���ˁB��������n�}�ƍl�����100ml�̐���10���ɂ���ɂ�(266/485x)/(100+216/482x)=0.1�@�@x=19.7g
�ƂȂ�܂���ˁB����10g�n�����̂��A19.7g�n�����̂��Y������܂��H�a�����n�߂�����̏��X�������A�ƂĂ��Y���ɂ���l�ɕ��������Ƃ�����̂ł����A���̓����Ƃ����̂��A�u10g�Ɍ��܂��Ă��邶��Ȃ��́A�a���͂���ȍׂ����v�Z�͂��Ȃ��̂�I�v�Ƃ������Ăȉ������B���̎����͕a���̂��炵���ɖڊo�߂܂����B
�ԐM�@���������Ă݂�ƁA�V�i�̓S�݂傤��ł͏o�Ȃ��悤�ȋC���E�E�B���Ȃ݂ɓ��@�ł́A����2%�S�݂傤�������Ă��܂��B������A���Ȃ������E�E�E�B(;_;)�@�u���S�~���E�o����n�������ۂɗn���Ȃ��Ŕ������a�����c������Ƃ������ƂȂ̂ł����ˁA����Ƃ��n�������ǂ��炭����ƒ��a�����͏o���Ă����Ƃ������ƂȂ̂ł����ˁB�v�O�҂��Ǝv���܁`���B�S�݂傤��̐����ɂ��Ē��ׂĂ݂܂����BKoso
Chemical Co., Ltd�@���_�A�����j�E���S(III)�E12���@Ammonium Iron (III) Sulfate 12-Water, G.
R.�@FeNH4(SO4)2�E12H2O FW: 482.19�@Assay:
Minimum 99.0%�@Maximum Impurities�@Chloride (Cl) ------- 5ppm, Nitrate(NO3)
-------- 0.005%, Phosphate(PO4) ------ 0.001%, Sodium(Na) ---------- 0.01%,Potassium(K) -------- 0.01%, Copper(Cu) ---------- 0.002%,
Magnesium(Mg) ------- 0.001%, Calcium(Ca) --------- 0.01%, Zinc(Zn) ------------ 0.003%, Lead(Pb) ------------
0.001%, Manganese(Mn) ------- 0.005%, Iron(II)(Fe2+) ------ 0.001% �J���V�E���̍������������悤�ȋC�����܂��B�����J���V�E���Ȃ��l�����邩�ȁ`�Ȃ�Ďv�����̂ł����A���̗ʂȂ�n���������ł��ˁB���a���邭�炢��������̂Ȃ��l���₷����������܂���ˁB
>�u10g�Ɍ��܂��Ă��邶��Ȃ��́A�a���͂���ȍׂ����v�Z�͂��Ȃ��̂�I�v
>�Ƃ������Ăȉ������B���̎����͕a���̂��炵���ɖڊo�߂܂����B
����܂��A����܂�����������(^_-)2ml�����̂Ƀz�[���s�y�b�g���g������A�ɏՉt������̂Ƀ��X�t���X�R�������Ă݂���E�E�E�B�܂��A�܂��a���̉��[���ɋC�Â��ĂȂ�����̘b�ł��ˁB���ȂA���X�V�����_�[����g��Ȃ����Ƃ������E�E�E�B��t�̒��a�����A�����j�A�ŏ����̂ɓH��̂悤�Ɉ�H��H�����邨�������Ă݂���E�E�E�B����(�o��)�Ƃ͋��낵�����̂ł��B�������Ĉ�Ă�ꂽ�������A���@�������̋C�����A�����Ƀ~���E�Ȃ�����肪�����c���Ă��܂��ˁB�͂₭�����Ă����Ȃ���E�E�E�B�܂��A�F�Ƀo�J�ɂ���Ă��܂��E�E�E�B(^_-)�@�b�ς�@���̊ԁA�ɏՉt���̈˗�������܂��āA���̔��ʋZ�p+���X�V�����_�[�ł̃��X�A�b�v�Z�p�ł�����ł����B�M�p���Ă��炦�Ȃ��̂ŁApH���͂����Ă݂����Ȃ�A�Տ����w�̐l�ɂ͓����Ō��t�K�X�̋@��ő��肵�Ă��܂��܂���(�����Ȃ�����)�B(���@�ɂ͊Ȉ�pH����@�킪����܂���)
�ԐM�@�ǐL�ł��B�������a���́A������������Ə�������悤�ł���(^_-)
�ԐM�@�����u���ė₦��Ƃ܂��͏o����̂ł����ˁH�C�ɂȂ�Ȃ��߂��Ďg�p����Ηǂ��̂ł����ˁH
�ԐM�@���@�ł́A���a���Ă��悤���A���Ă��Ȃ��낤�����\���Ȃ��ɐ��߂Ă��܂��B�ł��A���܂�ɂ͂܂�������肠��܂���B���������Ƃ���A�C�ɂȂ�Ȃ��߂���Ȃ����Ȃ��ł��ˁB���@�ł́A�S�݂傤��͖���n�����Ďg�p���Ă���A�ۑ��t����߂�����@�͍s���Ă��܂���B�����̑O�ɂł������n������(�~�L�T�[�g�p)���u���Ă����ƁA�ߌ�̎d�����n�܂�Ƃ��ɂ͉����Ă��܂��B�e���100ml�̑傫�Ȏ����ǂ��g�p���Ă��܂��B�߃}���K���_�J�����g�p���ɗn�����Ă��܂��B������n���ɂ����̂œ����悤�ɂ��Ă��܂��B
�ԐM�@�S�݂傤��̗e��̃��x���A�ϐF���Ĕj�ꂪ�������肵�Ċm���Ɂ@�Â������I�ł��D�n�߂č�����l���g�n���܂��[���I�h�g�Q���ł����߂ł��[�I�h�g���߂���E�E�ςł��[�I�g�H�H�H�{���Ă��g�n���ɂ����E�E�h���Ȏ��ǂ��ɂ��Ȃ����E�E�������߂������E�E�ŁA�_���݂ł����D�A�h�o�C�X������ā@���a���L��@�Ő��߂Ă݂āA���܂�܂����I���܂ł��n���Ȃ�������H���a���������肵����ł��ˁA�V�����{�g���͂�����E�E���������Ă݂܂��D�ӎ�
�ԐM�@�S�݂傤��ɂ��Ē��ׂĂ݂܂����B�S�݂傤��Fe(NH2)(SO4)2�E12H2O ����482.2�~���E�o���̈�ŁA�K���I�ɂ͓S�݂傤���FeK(SO4)�E12H2O���w�����A�s�̕i�ł͑������̂��̂�S�~���E�o���Ƃ����Ă���B���F�`�W���F�B�������n�̐����ʑ̌����B���x1.732g
cm-3(18��)�B�Z�_40���B���𐫂�����B150���łقƂ��0.5���a���ƂȂ�A230���Ŗ������ƂȂ�B���Ɉn�B���_�S(II)�Ɨ��_�A�����j�E���̍������n�t�ɗ��_�������ēd���_�����Ă���B���n�t�͎_���Ŏ��������B�}���܁A���i�Ƃ��ėp�����Ă���B�Ƃ̋L�ڂł����B���͂��̕��𐫂ł��B���Ȃ݂ɕ��𐫂����ׂĂ݂�ƁE�E�E�B����(efforescense)���a���̌�������C���Ŏ��R�ɐ��a���̈ꕔ�܂��͑S���������ĉ��A�����ɂȂ錻�ہB���Ƃ��ANa2SO4�E10H2O����������C���ɒu���Ɛ����C������ĕ�����Na2SO4�ƂȂ�B����2�����n�ł́A�ő���2���Ő����C���Ƃ��킹��3���ƂȂ�A�����ɂ�鎩�R�x��1�ƂȂ�B�]���āA���x���ł͕��t�ɂ����鐅���C�̕����͈��ƂȂ�B��C���̐����C���������̈��l���Ⴂ�Ƃ��ɕ������N����B���w���T�@�������w���l�o�ł��ƂȂ��Ă��܂��B�]���ČÂ�����̕����͗��_�S�Ȃǂ��l�����܂��ˁB�������A���̕����͐��ɗn���܂��B�n���t�̔�������������ł���m�͂���܂���B
�ԐM�@�V�����S�݂傤��́E�E�������̂��邤�����̌����ŏo���オ����10���n�t�͐Ԏ��F�ŃX�b�L���Ɨn�������āE�E�����������I�ł��D�N����̂̓S�݂傤��ł̓X�^�[���[�̉�]��ǂ��ā@���܂ł�������̂��̂��������t�������������ŁE�E�n���Ȃ��I�Ǝv�����̂ł��ˁD�E�E�������n����Ƃ��ɁA�������ɕs�n���̕������������A�ƌ������Ȃ̂ł��傤���D�܂��C�o���オ�����n�t�̕ۑ����ɐ����镲����̂��̂����������炵���E�E�̂ł����D�O�a�n�t�Ƃ��̌����̐͏o�Ƃׂ͂��́H�@�ł����߂ď�����̂Ȃ�Č������H���w���ȁ[�I�Ɗ����E�E�Â��Ȃ��āg�h�����ł���ˁD20�N�ȏ�O�̃~�N���g�[����@20�N�߂��t���[�U�[�Ȃǂƕt�������Ă��āg�Â����́E�E������܂��A���C�I�̕a���h�̃q�g�ɂȂ��Ă��܂��D
�ԐM�@20�N���́A�u������܂��`�v�Ȑ��E�ł��B�ł��A�ŋ߂�20�N���̂ɍŌ�̈ꌂ�������ĕ������̂ɂ���e�N�j�b�N�����Ă��܂����B�����āA���[�ɓ����Ă��ᔃ���Ă���Ȃ�������B(^_-)�����䂤�������ƂT�N��20�N���̂ɁE�E�E�B�ꌂ�������Ȃ��悤�ɒ��ӂ��Ȃ���E�E�E�B(-
- ;)�S�~���E�o���ɂ��Ă͂����������ׂĂ݂܂��ˁB�}���Ȃ�Ă����Ă��ǂ̂悤�ɋ@�\���Ă��邩����킩��Â炢�ł���ˁB
�ԐM�@�S�݂傤��ɂ��Ăł����A�Â��Ȃ��Đ͏o���镨����Fe(NH4)(SO4)2�P�̂ƍl���ėǂ��悤�ł��B�S�݂傤���K���ȗe��ɂ���ăI�[�u���ŏĂ��Ă��ƁA�������̂Ƃh�Ă����H�h�ɂȂ�Ǝv���܂��B�Â��S�݂傤��ŗn�����Ȃ������Ɋւ��Ă�����Ɠ��l���Ǝv���܂����A�Ă����H������Đ��ŗn�����Ă݂Ȃ��ƂȂ�Ƃ������܂���B�������A�n���Ȃ������炻�̉\���������Ȃ��Ă��܂��ˁB
�ԐM�@��������Ƃ��Ȃ��̂ŕ����I�Ȃ��Ƃ���������܂��A�����i�a���Z�p42;6-8;1990)������ƃy���I�L�V�_�[�[���F�Ɋr�ׂėz���זE�������Ȃ�X���ɂ���B���t�D��������苭�����F�����B�얞�זE�����܂�B�Ƃ����_�Ńy���I�L�V�_�[�[���F�ƈقȂ�悤�ł��B���ł��D�_������ɋ������F���邽�߂ɍD�_���������F�Ƃ��Ĕ��\���Ă�����̂�����܂��ˁB�i�Տ��a��30;1137-1141;1982)�@�����ł����A���܂�n�b�L���������Ă��Ȃ��ƌ����̂����Ǝv���܂��B�����̃X���t�H���_��������Ƃ̊Ԃ̃C�I���A�������͐Ód�C�����Ɛ��@�����B�Ƃ̋L�ڂ��炢�������̂Ƃ��댩������܂���ł����B�iStain
Technology 56;323-325;1981)
�ԐM�@�y�f�����ɔ�r���āA���w��������̂ƂȂ���F�͂ǂ����Ă�����ٓI�Ȕ������Ă��Ă��܂��܂��B�y�f�̂悤�Ȋ���ِ�������A�ړI���Ƃ��Ă��ǂ��Ƃ͎v���܂����E�E�E�B�Ȃɂ��A�F�f�E�`�����̌����ł����炿����ƕs�����E�E�E�B
�ԐM�@�������������R�Ȃ�ł����A�����o���ꂽ���������ŁAPOD���F������Ă���Ȃ����ƌ����܂��āB���͑g�D��POD���F�͂�������Ƃ������̂ł����A�����ؕЂȂ�ł���ˁH�����Ă��܂��܂����B�����Ɏ��{�����������h�̕���POD������Ă����̂ŁA�d���������̂ł��̕W�{�����肵�悤�ƍl�����̂ł����A�����o���Ȃ����ȂƎv���Đ��F�̖{�����Ă����炱�̐��F���ڂ��Ă��܂����B���߂Ă݂���A���ꂢ�����������܂��Ă���܂����B�������A�����{�ɂ͌����������ĂȂ��APOD�Ƃ̈Ⴂ����ِ��ȂNj^��_�������̂ŁA�ǂ����悤���ȁH�Ǝv���A���₳���Ă��������܂����B��p�ɂ͂Ȃ�Ȃ��݂����ł��ˁB������߂܂��B
�ԐM�@���y���I�L�V�_�[�[���̂��̂����o����A���邢�͒�ʐ������߂�Ȃ�s�K���ł��傤���A�����n�A�����p���n�̊ӕʂƂ��āA�O�����Ⴂ�Ƃ����̂𗝉�������Ŏg���Ȃ��p�ɂ��Ȃ肦��̂ł͂Ȃ��ł��傤���B
�ԐM�@�@�߂����ɊJ���Ȃ����̂ŁA�F����̃��[���̂��Ƃ�̔M�S���ɂ͌h���������܂��B���ɓ���������͉̂�������܂��ꌾ�B�����ɂ��Ă͑S�����y�ł��܂��ADFS���F��R���S�[red���F�͂����Ɛ̂���A�~���C�h�̐��F�݂̂Ȃ炸�D�_������ߏo�����߂ɗp�����Ă���܂��B�܂��APOD���F���p���t�B���ؕЂł͂ǂ����Ă������ł��B�i�t�g�[��ASD���F�Ȃǂ�����������F����Ƃ��Ɖu�g�D�w�I�ɍR�̂�p���Đ��F����Ȃǂ̑�p���\���Ǝv���܂��B����Ȃ�ł����́H�����A�o�E�g����Ԃł��I�I
�ԐM�@���ƁC�K�v�Ȃ̂́C�g�C�����h�Ɓg����h�ł����ˁ[(^.^)V
�ԐM�@�����Ɛ̂ɂ́A�R�b�g����V���N�Ȃ���߂Ă����悤�ł���B(^_-)�@���@�ł̓i�t�g�[��ASD���F������������߂Ă��܂��B�i�t�g�[��ASD���F�ł́A��̋�����邱�ƂȂ���A�n�}��N,N-�W���`���z�����A�~�h�̗����F���ɑ傫���e�����܂��ˁB���@�ł͌��\�p�ɂ�N,N-�W���`���z�����A�~�h��V�����Ă��܂��B����Ȓ���܂���?
�ԐM�@���܂��z�b�g�i�H�j�V�b�t�ł���Ƃ����O��ł��b���܂��B50�x�ȏ�̉��x�ł�ߑ��������Ɖߏ�Ƀt�N�V�����������ĐԂ��Ȃ�܂��B����1N���_��������̂��h�ߌ�łȂ��Ƃ�͂�ߏ�̃t�N�V�����n�����Ă��܂���͂�Ԃ��Ȃ�B�{�ɂ���Ă݂�ȍ����Ă����h�߂���Ə����Ă���̂����邪���̂悤�ɂ���ƐԂ��Ȃ�₷���B���F�@�̂��ׂāi��2�Łj�Ȃǂ͂����Ə����Ă���̂ł����߁B
�ԐM�@���ݏ�L���@�ɂč쐻���ł��B����t�N�V���̓N���}�̃_�C�������h�t�N�V�����g�p���Ă݂܂����B�o�߂͏���(^_-)��O���オ�y���݁E�E�E�B���Ȃ݂Ɏ��s�����̓R�[���h�ł��B
�ԐM�@�V�b�t�쐻�v��A���s�ɏI���܂����B��͂芌�F�`���F�͏������܂���B�����炭�A����Ŋ����Y�����Ă����ʂ͓��l�ł��傤�B�ǂڂ��łȂ�(;_;)
�ԐM�@���Ȃ�́i1978�N�j�ɂ��낢��ȃ��[�J�[�̉���t�N�V���ŃV�b�t�t������Ĕ�r�����f�[�^�[������܂����A����ɂ���chroma��Diamont
fuchsin�@��72���Ԍo�ߌ���Ԗ����Ƃꂸ�s�ƂȂ��Ă��܂��ˁB���Ȃ݂ɂ��̎��ǍD�ł������̂�14��ޒ��ȉ���3��ނ�Chroma
Parafuchsin, ���������@���_�p�����[�Y�A�j�����i���b�g�Ⴂ2��j�ł����B���ꂩ�琏�����Ԃ��o���Ă���̂ň�T�ɂ͌����Ȃ��Ǝv���܂����A�F�f�ɖ�肪����̂ł͂Ȃ��ł��傤���B
�ԐM�@�ʏ퉖��t�N�V���Ƃ����ƃ��[�Y�A�j�����ƃp�����[�Y�A�j�����̍������ł���A�p�����[�Y�A�j�����̊����������قǐ��F���͗ǂ��悤�ł���B�������p�����[�Y�A�j�����Ƃ��Ďs�̂���Ă��鐻�i�ł��p�����[�Y�A�j�������`���U���̂̍������̂��̂�����A�������i�ł����b�g���ɈقȂ邱�Ƃ͒������Ȃ��悤�ł���B�������ȒP�Ƀp�����[�Y�A�j�����̏��x�����肷����@���Ȃ��A���ۂɍ���Ă݂���肪�Ȃ��̂����ۂł��B���̕ӂ��̂���݂Ȃ����Y�܂��Ă��������ł��낤�B�O���R�b�g���F(���_���̂R)�ɏ����Ă���ROSANILIN (MAGENTA I)(CI) [C.I. Basic Violet 14] C.I.
42510��Merck�Ђ̋Z�p���ɂ��ƃV�b�t����ɓK�����APARAROSANILIN (MAGENTA O) [C.I. Basic Red 9] C.I.
42500�̕���E�߂Ă��܂��ˁB
�ԐM�@������Ăǂ��������ƂȂ̂ł��傤���B����t�N�V���Ƃ́A���낢��ȐF�f�̍������Ȃ̂ŁA���̊����Ƃ������A��������Ă��镨���̎�ނɂ���ĈႢ������Ƃ������ƂȂ̂ł��傤���B
�ԐM�@�킴�킴���肪�Ƃ��������܂��B����ς�A����t�N�V���������̂ł��ˁB�܂��A�g�p�����F�f�����Ȃ�Â����̂������̂œ����̂܂܂��Ǝv���܂����E�E�E�B�����Ă����悤�Ȃ�A�����Ă݂悤���ȁE�E�B�ł��A���ۂɃV�b�t������Ă݂�Ɩʔ������Ƃ��킩��܂��ˁB����t�N�V���ɂ���Ĕ��F�ɖ��炩�ȈႢ������܂����B���F�`�Ԋ��F�܂ł��܂��܂ł����B�������w�̐F���Ɍ�����Ă��鎄�ɂƂ��Ă͔��Ɏh���I�Ȍo���ł����B�܂��A�쐻���ɏd�����_���ߏ�ɍ�������Ɗ��F�ɋ߂��Ȃ�Ƃ������Ƃ��킩��܂����B���ݎ��̓V�b�t�ɋÂ��Ă��܂��āA�_���ȂǂɊւ��Ă��������Ă��܂��B���_�͂Ƃ����܂��ƁA�߃��E�f�_�Ŏ_���������̂������ԐF���F���܂��B�ߎ_�����f�Ŏ_�������ꍇ�ɂ́A���_���ŃV�b�t����Ɣ������������̂Ƒ卷����܂���B�߃}���K���_�����̂��̂͋������F��悷�邪�I�𐫂ɖR�����B�Ƃ����悤�ȋ�ł����B���l�����邱�ƂƂ��ẮA���̂ł̃V�b�t�����Ɋւ��Ă͎_�����������Ĕ��F�������@�ƂȂ��Ă��܂��B���̎_���͉߃��E�f�_�ȊO�ł͂��߂Ȃ̂ł��B�܂�A�����ɏ����Ă���߃��E�f�_�̖����Ƃ͒P�Ȃ�_���ł͂Ȃ��ƍl�����܂��B���̂Ȃ�A�P�Ȃ�OH��̎_���Ȃ�Ήߎ_�����f�ɂ��_���ł����F���Ă��Ȃ���Ȃ�Ȃ�����ł��B�V�b�t�̌����Ƃ��Ă��낢�돑���Ă���܂����A���ꂪ�{���Ȃ̂�����^��Ɋ����Ă��܂��܂��B�������A�ȑO�ɂ��̃��[�����O���X�g�ŏЉ���V�b�t�̌����Ɋւ��Ă���������̈��p������߂������̂ł���A�����g�Ƃ��Ă͋^��_�̉�̂悤�Ȃ��̂ł����B���ݎ�����ʂ��Ă̌����͂Ƃ����ƁE�E�E�B�ǂ��炩�Ƃ����ƁA�אڂ�OH���L����Y�f-�Y�f�̌�����ؒf���A�ؒf���ꂽ�����̎�ɉ��炩�̕���(�Ⴆ���E�f�_)�Ȃǂ���݂��邱�ƂŐؒf���ێ�����Ă���ƍl�����ق������R�Ȃ悤�ȋC�����܂��B(�����܂ł��l�I�����ł�)
�ԐM�@����ρA�Ȃ��Ȃ������ɂȂ�Ȃ����[(�e.�f)!?�e�C�����f������Ȃ���Ȃ��́[�I�H�������f�_������A�����Ɠ����ɂȂ�Ǝv����[(^.^)V�@����ł��_���Ȃ�A�y�f�p���[�́e�g�b�v�f�Ƃ�����Ă݂��肵�ā[(~.~)!!!����t�N�V����p�����[�Y�A�j�������A���C���ƈꏏ�ŁA�Ƃꂽ�ꏊ�E�N��E�������@�Ȃǂɂ���Ă��Ⴄ�낤���H�i�ł��A�s�̂̃V�b�t�͏�ɓ����Ȃ̂ŁA����ϗ��Z������̂ł�����낤�[(-.-)!?�j
�ԐM�@��قǂ̃��[����PAS���F�̎_���܂ɂ��ď����G�ꂽ�̂ŁA���ꂱ��l���Ă݂����Ǝv���܂��B���������A�Ȃ��_���܂ɉ߃��E�f�_���g�����s�v�c�Ɏv���܂���?�@���̎_���܂���_���Ȃ�?�@�����ׂĂ݂܂����B
�߃��E�f�_�́A�_���Ƃ�����p������܂��B���ꂪ�`���b�g����ȍ�p������̂ł��B�_���̋@���͂Ƃ����܂��ƁE�E�E�B1,2-�W�I�[���̉���p�����ƂȂ�܂��B�����
- C - C - HIO4 - C
- C - - C =
O O = C -
| | ----->
�_�@�^ -------> | |
OH OH
O = I = O
H H
(�W�I�[��)
|
OH�@�@�@�@�@�@�@�@�@�@+ H2O + HIO3
�@�@�@�@�@�@ (��߃��E�f�_�G�X�e�����ԑ�)
�Ƃ����@���ƂȂ��Ă��܂��B�܂�אڂ�����OH���L���Y�f-�Y�f�̌�����ؒf�����ڂ�����킯�ł��B�ł́A���̔����͗א�OH��ɂ̂N����̂��Ƃ����ƁA�����������̂ł��Ȃ��悤�ł��B�߃��E�f�_�ɂ���������́A�}���v���[�h����(Malaprade
reaction: 1928�N���\)�Ƃ���2-�A�~�m�A���R�[���ł��N����Ƃ���Ă��܂��B
- C - C - HIO4 - C
- C - - C =
O O = C -
| | -----> �_�@�^ -------> | |
OH NH2 O = I
= O
H H
(�A�~�m�A���R�[��) |
OH�@�@�@�@�@�@�@�@�@�@+ NH3 + HIO3
�@�@�@�@�@�@ �@(��߃��E�f�_�G�X�e�����ԑ�)
���̔�����
- C - CH2 - C -
| |
OH OH
orNH2
�ł͋N����܂���B�܂��A��̃J���{�j����אڂ����ʒu�ɂ��郿�W�P�g���A���P�g�_��J���{�j����ƃq�h���L�V����אڂ��Ă��郿�q�h���L�V�P�g���Ȃǂ��߃��E�f�_�Ɣ������邪�A�J���{�j����̓J���{���_�ƂȂ�B���̗��_���炢���ƁA�A�~�m�_�ł̓Z�����E�g���I�j���Ȃǂ��ΏۂƂȂ�܂��B�������A�����̓��^���p�N���͑ΏۂɂȂ�܂��B�������A���ۂ�PAS���F�ł��̔������ŏI�������܂œ��B���Ă��邩�͂킩��܂���B�_�����Ԃ�������A�ߏ�ȗʂŎ_������Ȃǂ̌������s���Ă݂Ȃ��Ɗm���Ȃ��Ƃ͌����܂���B�܂��A�P�Ȃ�_���Ƃ����T�O�ʼnߎ_�����f��߃}���K���_�J���E���Ȃǂ��g�p���Ă����ɂ͂�����Ȃ��\���������ł��B�������A�߃}���K���_�Ɋւ��Ă͖��@�������ł��邽�߂Ƀ}���K���̍�p�ɂ���Ĉ�����`�̔������N�����Ă���\���͔ے�ł��܂���B
�ԐM�@���̎_���܂���_���Ȃ�?�@�������f�_�Ƃ�(^.^)?
�ԐM�@�܂��߂ɓ����Ă����ł���?(�[�[;)���炭�_���ł��傤�B��قǂ̃��[���ɂ��������悤��
- C - C - HIO4 - C
- C - - C =
O O = C -
| | -----> �_�@�^ -------> | |
OH
OH
O = I = O
H H
(�W�I�[��)
|
OH�@�@�@�@�@�@�@�@�@�@+ H2O + HIO3
�@�@ �@�@�@�@�@(��߃��E�f�_�G�X�e�����ԑ�)
��߃��E�f�_�G�X�e�����ԑ̐������̃��E�f�̐U�镑�����d�v�ł��傤�B�悭�}�������������B���E�f-�Y�f�̓�҂ɂȂ��Ă��錋�����������ƂȂ肻���ł��B�Y�f-�Y�f�̌����͍��Ƃ��ɂ���J���܂����A�����Ƃ��ɂ����ɋ�J���܂��B����ȉ��߂ł����A�����ɂ��Đ��������Ă��炤�ƁA�W�I�[���̕Е��̐��_��ɑ��ă��E�f���������܂��B����ǂ����E�f�͂܂���������]�͂������Ă��܂��B����Ƌ߂��Ɍ����ł���悤�Ȍ��f��T���킯�ł��B���̉e���͂̋y�Ԕ͈͂��Y�f-�Y�f�̌��������Ƒ������ǂ��̂ł��傤�B�܂�A�ׂ̂������ɂ��鐅�_��܂ł͎肪�͂��Ȃ��ƍl�����܂��B�����āA�אڂ��鐅�_��������̂��ĒY�f-���E�f-�Y�f�̎O�p�W��z���グ�܂��B�l�Ԃł������ł����A�O�p�W�Ȃ�Đ��������Ȃ���Ԃł���ˁB���q�����l�ł��B�O�p�W�ɂȂ邱�Ƃɂ���āA�Y�f�ƒY�f���m�͒��������Ȃ�܂��B�܂�A���������B�����āA�ǂ���ƌ�������Ƃ�����ł��Ȃ����E�f�͓�l�̒Y�f���痣��Ă����E�E�E�B�����āA�藣���ꂽ�Y�f�y�ђY�f�͎��炪�A���f�q�h���`�����Ă����B���ꂪ�A���̔����̃��J�j�Y���ł��B(�܂��A�����ɂ͓d�q�J�ڂȂǂ̋@�\����������̂ł�������̂Ő������܂���)���`��A�����l�ԊW�ɂ����Ă���E�E�E�B�ł�����A�Y�f-�Y�f���ɂ�郈�E�f-�Y�f�̔����ɂ͈��������ł��ˁB���m�ɂ͈�����������ł��ˁB(^_-)�������f�_�̏ꍇ�ɂ͓�̌��q�Ԃ������炷��\�͂̂��閳�@���q�����݂��Ȃ��̂ŎO�p�W�����藧���Ȃ��̂ł��B�܂�A�_�f���������邾���̎_���ł͒Y�f-�Y�f�̌�����ؒf�ł��Ȃ��ƍl�����܂��B
�ԐM�@���́A���̂悤�Ȍo���͈����܂���B�{���A�O�̂��ߊm�F�������s���Ă݂܂����B�T�v�́A�V�b�t������}�C�i�X20���܂ŗ�₵����������B���̌�A�����ɕ��u���āA�����̗L�����m�F����Ƃ������̂ł��B������Ƃ�����Ⴂ�ŃR�[���h�ł͂Ȃ��_�Ǝd���̍��ԂŊώ@�������߂Ɍo���ω��������_���ł��B���ʂ͂Ƃ����ƁA�������݂Ƃ߂܂���ł����B�Ƃ������ƂŁA�����͑��ɂ���Ǝv���܂��B�ŋߎ�I�ɃV�b�t������������肵�Ă�����ł����A���������V�b�t����Ƃ������̂́A���Ɍ���ꂽ��������\������Ă��܂��B�F�l�����m�̂Ƃ���A�g���͉���t�N�V���A�d�����_�i�g���E��(�����_�i�g���E��)�A���_�A���ł��B�����ŁA�����̌����Ƃ��Ĉ�ԍl�����鐬���Ƃ��ẮA��͂�d�����_�ł��ˁB�������w�ł͂��̂ǂ�����g�p���Ă���̂��͂悭������Ȃ��̂ł����E�E�E�B���w���T�Œ��ׂĂ݂܂��ƁE�E�E�B�����_���f�i�g���E��[sodium
hydrogensulfate]=�d�����_�i�g���E��NaHSO3 MW104.06�A�����_�i�g���E��[sodium sulfate]�@Na2SO3 MW
126.04���L���ׂ������͂Ȃ��̂ł����A�ǂ�����G�^�m�[���ɕs�n�Ƃ����L�ڂ�����܂��B��͂�A�����̌����Ƃ��Ă̓G�^�m�[�����̍�������ԍl���₷���ł��ˁB���Ȃ݂ɁA����Ɋւ��Ď��������Ă݂܂����B�R�[���h�V�b�t(����)�ɃA���R�[��(���@�ł̓G�^�m�[���E���^�m�[���̍����A���R�[��)�������Ă����Ƃ����P���Ȏ����ł��B���ʂ́A�����͔����������܂����B�������A��s���N�F���łĂ��܂��܂��B���̃s���N�F�ɂ��Ă��ʔ����l�@���ł��܂��B�V�b�t����ɃA���R�[���������邱�Ƃɂ�锒���y�уs���N�F�̒��F�́A���ꂼ��ʂ̋@�\���琬������B�����Ɋւ��ẮA�O���ɏq�ׂ��悤�Ɉ����_�i�g���E���y�яd�����_�i�g���E���̓G�^�m�[���ɕs�n�Ȃ��߁A�������ꂽ�G�^�m�[���ɂ��s�n�����N�������̂ƍl������B�s���N�F�̒��F�́A�A���R�[���ɂ���߂ɂ���č����t�S�̂�pH���㏸���邱�Ƃɂ��A�V�b�t����̓A���f�q�h��Ƃ̑I�𐫂����ނ���B�����āA�A���R�[���̂���OH��Ɣ������g��550nm�̐ԐF��悷��B�ł��B���Ƒ��ɍl�����錴���Ƃ��ẮA���炩�̖��@����(�����n)�����������Ƃ������Ƃł��ˁB�����_��d�����_��-SO3��͔z�ʎq�Ƃ��Đ��������܂��B�܂�A���炩�̋����C�I�������݂����ꍇ�A���S����-�z�ʎq�̌����܂���̂��`�����₷������������܂��B�������A���̂��`�������ꍇ�ɂ͂��̕��q�����ɋ���ƂȂ邽�߂ɁA�������������a���Ă���\���������Ǝv���܂��B�����̂�������{���ɍ������Ȃ����������Ċm�F����K�v������Ǝv���܂��B����Ȋ����ł������ł��傤���E�E�E�B
�ԐM�@��MIB-1���L���ňꌎ���炢�ł��߂ɂȂ�܂��ˁB��-20���Ƃ��ɕۑ����Ă����Ə����͂����������̂ł����ˁB��AMeX�Ȃu���b�N��4���ŕۑ����Ȃ��Ǝ�������Ƌ�����Ă��܂��ˁB�ŋ߁A�x���g�R���x�A���g������ʐ��Y��������������Ă��܂��B���i�̃g�����h�������I�Ŏ���̃j�[�Y�ɂ����ɑΉ����邽�߂Ɉ�̐��i����l�őS�č��悤�Ȍ��Y�����ɐ�ւ����Ƃ����₿�܂���B�ؕЂ���ʐ��Y�͎��オ�����Ȃ��̂ł��傤�B
�ԐM�@���Č����b���ł���ˁB�Ȃ����ɂ����Č��ɓ��Ă�ƈ����Ȃ�Ęb����������������܂��B�킽�����������܂ł͂킩��܂��A�M�d�ȏǗ�Ȃǂ͐ؕЂ��ƃp���t�B���ɂ��ăJ�o�[�Ȃ��āA���ɂ߂Ă��܂��Ȃǂ͂������ł����H���ꂾ�ƁA�ʂ��o���Ԃ������X���Ă��܂��̂Ŕ����ď��Ȃ���͔��ɃL�r�V�[�ł���ˁB
�ԐM�@���A����{�C�Ō������Ă��܂��B(^_-)V�@���Ԃ̂����錟���Ȃ̂ŁA�܂����ʂ͏o�Ă��܂��E�E�B
�ԐM�@�{�C�Ƃ����Ă����}�Ɍ��ʂ��o�����̂ł��Ȃ��̂ŁA�����������ǂ��ł���(^_-)�B�R���̎����Ɋւ��ẮA���@���镔�����������݂��܂��B���̌����I�ȕ����̂��������̌��������Ă͂���̂ł����E�E�E�B�܂��A���ԕ̈��͂��̉�ɓ���܂��B
�ԐM�@�h�f�W�^���J�����̕a���ւ̗��p�ɂ��āh�Ɋւ��Ă�1997�N�̗Տ��q�������w��Ŕ��\�����̂�������ԍŏ��̕��Ǝ������Ă��܂��B���̎��Ƀf�W�J���̃����Y���������̐ڊ���Y�ɒ��ڂ��ĎB���Ƃ������ƂɐG��܂������A��ɂ��̕��@�ɉ��Ƃ������l�̖��O���t���Ă��܂����B�����ƋZ�p
vol28. no.4 p360-361 2000�Ɏg�p�\�ȃf�W�J���Ȃǂ��o�Ă��܂��B�������ʐ^�̎B�e���\�Ȏs�̂̃f�W�^���J�����ɂ���http://www.asahi-net.or.jp/~me9k-ogw/kanaria.html�������ł͌������B�e�p�FFinPixS1
pro�APixela 150CL�}�N���B�e�p�FCamedia C-2500L�@����p�FEPSON PM-3500C�Ȃǂ��g�p���Ă��܂��B���p�@��Ńs�N�g��������܂����A�ŋ߂͂قƂ�ǎg�p���Ă��܂���B40���~���i�p�\�R���������j�ł��Ȃ�̃V�X�e�����g�߂܂��ˁBFinPixS1
pro�͈��t�^�C�v�Ȃ̂�C�}�E���g�ŋ����ɊȒP�ɂ����܂��B�܂����͎��Ƀp�\�R�����s�v�Ȃ̂ł��낢��ȂƂ���Ɉړ����Ďʐ^���B��܂��B�����u���i�p�\�R�����K�v
HC2500�̂悤�ȃ^�C�v�j�ł͏�L��Pixela 150CL���ǂ��ł��ˁB�{�̂�����15���~�قǂł����A��p�Ȃ��Ōu���ʐ^���B�e�\�ł��B������G�v�\����PM�V���[�Y�Ȃ猈���ăs�N�g���ɗ��܂���B�i���������͂����Ƃ������̂�I��ʼn������B�S�R�F�������Ⴂ�܂��j�t�B�����̎g�p���߂����茸��܂������A�n�[�h�f�B�X�N�͖��^����Ԃł��ˁB1G�����邪1G�����Ȃ��ɕς��A����100G�ʂȂ��ƕs���ł��ˁB�t�B�����̕ۑ��ɂ�����ɂ߂܂������A�f�W�^���f�[�^�[�����̐���l����ƂȂ�炩�̑���Ƃ�Ȃ���Ȃ�Ȃ��Ȃ肻���ł��ˁB�i�ł�100T�i�e���j�̃f�B�X�N�Ƃ��ł��Ă��̂܂ܕ����ۂ��Ă��������B�j���ꂩ��Î������S�Ɏg��Ȃ��Ȃ�܂����ˁB�i���͕��u�����Ɖ����Ă��܂��ˁj���e�p�ʐ^�͂�͂��掆�łȂ����...�Ƃ������������Ȃ��Ȃ�A�G�����قƂ��O.K�ł��ˁB�t�Ƀf�W�^���f�[�^�[��v�����Ă���Ƃ���̕��������Ă��܂��B�́i���ł��jLP����CD�ɕς���Ă����ہA�������ȂɃA�i���O�ɌŎ����Ă�����X�����\���܂����B�a���Ȃǂ̃A�i���O�ʐ^���f�W�^���ʐ^�Ɉڂ�ς�낤�Ƃ��Ă��鍡�ACD�̎��قǃf�W�^���ɑ��Ē�R�����Ȃ��悤�ȋC�����܂��B�p�\�R���̕��y�Ȃǂ��f�W�^���ɑ��Ċ��e�ɂ������̂��ȁH���������R���s���[�^�[�ƈ�̉��������ڊ���Y�Ŕ`���̂ł͂Ȃ����j�^�[�Ŋώ@����^�C�v�Ɉڍs����Ɨ\�z����܂��B
�ԐM�@���@�ł�Nikon CoolPIX 990���g�p���Ă��܂��B�������ʐ^�͂���ŏ[�������܂��ˁB�זE�ł����v�ł�����B�܂��A���o�[�T���X���C�h���f�W�J���Œ��ڎB�e���ăf�W�^���摜�ɂ���Ȃ�Ă����r�Ƃ�����܂���B����ɂ��ẮA�������ڂ����ł���B�ǐL�@���̎�̏����đ�ł���ˁB�w�����̋@��I���Ȃǂɂ��Q�l�ɂȂ�܂����E�E�E�B�F������莝���̃f�W�J����ڊ���Y�ɂ��ĎB�e���Ă݂āA���ʂ��A�b�v���Ă��炦�܂���ł��傤���B���Ȃ݂�Nikon
CoolPIX 880�͂�����Ƃ��₵������OK�ł��B�܂��AFUJI FinPIX 1300?(�Y�[���Ȃ�)�͂��߂ł����B
�ԐM�@���@�ł� Nikon CoolPIX
5000���g�p���Ă��܂��B���̋@��͌������ʐ^�͎B��܂���B����̎B�e��p�Ŏg�p���Ă��܂��B�B�e�����摜��FileMaker Pro �Ɏ�荞��łc�a�����Ă��܂��B��o���}���f�W�J���ŕ��ʂ�����̎ʐ^�ƈꏏ�ɂc�a�Ɏ�荞�݂܂��B���o�[�T���X���C�h�ł���Nikon
CoolPIX 950,990,5000��2�����܂ł̐ڎʂ��\�ł��B�X���C�h���ʗpKit��Nikon����łĂ��܂��B���@�ł͑���B�e��̓��ߌ��𗘗p���ĎB�e���Ă��܂��B���_�͈Â��X���C�h�ł̓J�����̃����Y�̎ʂ荞�݂��݂��܂��A���邢�X���C�h�Ȃ�n�j�ł��Bdata
�́@buck up��LAN�łȂ������o�b�̂g�c�c�ɕۑ����e�ʂ���������b�c�q�ɏĂ��Ă��܂��B�o�͎͂O��̃v�����^�[�ŕ��A��o���}�A�W�{���x�������쐻���Ă��܂��B�v�����^�[�@EPSON
3500C,670C�x�m�ʁ@�@�@FMPR375E�i�h�b�g�C�p�N�g�j
�ԐM�@������ۂ̉摜�������Ă��������ł����A�Ȃ��Ȃ��ǂ������ł����(^_-)�܂��A�f�W�^���f�����≖�̉𑜓x�ɒǏ]���ĂȂ��̂��A���ڃ��o�[�T���t�B�������B�e���Ă�����掿�̒ቺ�͊������܂���ˁB�B�e����g���ăf���[�v(?)���쐻����Ȃ�ŁA�Ȃ�Ƃ��a���炵���ėǂ��ł���ˁB�J�����̃����Y�̎ʂ荞�݂Ɋւ��Ă��H�v����Ȃ�Ƃ��Ȃ�Ȃ����ȁ`?�܂��A��p�̂��̂��ꖜ�~�ȉ��ŏo�Ă���̂ŁA������g�����ق����m������
�ԐM�@�܂肨�Ȃ��y�[�W�̐}1�̗l�ȕ\�L���������Ƃ������Ƃł����ˁH���̘_���i������ҁj�����Ă����l�ȋL�ڂȂ̂Ō�A�ł͂Ȃ��ł��ˁB���̘_�������̋Z�p������̓]�L�̂悤�ł����A�匳���Ԉ���Ă����̂����邢�́A���ς������̂�������܂���ˁB�������}1�����̂܂܈��p���Ă���Ƃ�����݂�Ƒ匳���Ԉ���Ă����̂��ȁB
�ԐM�@�s���|�[���B�����ł��B>���̘_���i������ҁj�����Ă����l�ȋL�ڂȂ̂Ō�A�ł͂Ȃ��ł��ˁB�Â����W�J���e�N�m���W�̋L�ڂ��Ǝv���܂��B
�낭�ɒ��ׂ������ɔ������Ă��܂��܂����B
�����@�{���[�����O���X�g�n�܂��Ĉ˗��ő�̓��ł͂Ȃ��ł��傤��(>_<)����ς�A�����ł����(-_-��)�ǂ��̑��ɖ�肪�������̂��m�肽���ł��ˁB�ł��A�m�����Ƃ���łǂ��Ȃ��ł��Ȃ����E�E�E�B�i���V��𔖐E���F����悤�Ȃ��̂ł���ˁB���ɖ߂����Ƃ͕s�\�Ȃ̂ŁA�����W�{���ǂ̂悤�Ȑ��F�����������ɓ���ċ������Ă��炤�����Ȃ��Ǝv���܂��E�E�B�܂��A�f���Ɏӂ����Ⴄ���Ƃ��挈���E�E�E�B���ƁA�ǂ����Ă��̂悤�Ȃ��Ƃ��N������������������K�v������ł��傤�ˁB�������A�l�ӔC��Njy����̂ł͂Ȃ��A�Ĕ��h�~�ւ̑Ή��̈�Ƃ��Ē��ׂ�K�v������ƍl���܂��B�����W�{�͉ߐ��X��������悤�Ɋ����Ă���̂ł����A�ǂ̂悤�Ȑ��F�ԓx�ɂȂ�̂��肩�ł͂���܂���B���������A�����W�{�͂ǂ̂悤�Ȑ��F���������̂ł��傤��?
�ԐM�@���S�����������܂����ˁB�h���߂�Ȃ����������������������I���āh����������@�Ǘ��ł��ˁB�댯�������ς��a���������ł����̂ˁB���ŋ߂�炩���ĂȂ����̂ł��炨�ڂ��ł����j�����܂炸�^���Ԃ����i�g.�d�j�������悤�ȋC��...�H�B
�ԐM�@���@�ł��A��̓����悤�Ȃ��Ƃ������āA���̂Ƃ��͊m���A�Տ��ɘA�����āA�ӂ����Ǝv�������ǁc�B�������A����Ă��Ƃ͂Ȃ�����A�悭������������A�����ƕ������Ă����ł��傤�c�B���҂���ɂ͐\����Ȃ����ǁc
�ԐM�@�{���ł��ˁB���ɓ��@�͕���ؐ��u���b�N���g�p���Ă���̂Ō��̂̎�Ⴆ�⍬���Ɋւ��Ă͂��Ȃ肤�邳������Ă��܂��B�Ƃɂ����m�F�A�m�F�A�m�F�A�m�F�ł��B�������l�ł̊m�F�ł͂Ȃ����l���ōs���B�؋��͌���Ȃ��ۊ�(�f�W�J���E�R�s�[��)���Ă����A�O���B�����͍��E�F��������A�����悤�Ȑ�������͘A�Ԃŕt�Ԃ��Ȃ��A�ȂǂȂǁE�E�E�B�@��Ɋւ���g���u���́A����u��ւ��Ă���͌���܂����B�ȑO�̓��[�^���[�����g�p���Ă����̂ł����A�e���ɃA�\�r���łĕ�J�S�������Ԃ��Ă��܂�����A�N�����z���������ƈړ����āA���͗����A�g�D�͊������Ă��܂�����A����ł����B��@�Ǘ��ŏd�v�Ȃ��Ƃ́A��͂�X�^�b�t�Ԃ̃R�~���j���[�V�������Ǝv���܂��B���ׂȂ��Ƃł��A�ł���̐���肪�d�v�ł���ˁB�l�I�ɂ́A�l�d���邠�܂�A���̐l�܂����ō�Ƃ��s���Ƃ������Ƃ́A�Ǘ��҂̑Ӗ����Ǝv���Ă��܂��B�X�^�b�t�����S�ɍ�Ƃł�����𐮂��Ă������Ƃ��A�Ǘ��҂ɉۂ���ꂽ�`���̈�ł���Ǝv���Ă��܂��B
![]()